
Por Tony Hagen
China tiene solo 9 biosimilares aprobados frente a 29 en los Estados Unidos, y se espera que Estados Unidos se mantenga a la cabeza en esta carrera hasta 2027. Sin embargo, las reformas regulatorias fundamentales en China han establecido un marco para el desarrollo y la aprobación de biosimilares que fomentará una competencia sólida en ese mercado, según una presentación reciente de los abogados de propiedad intelectual (PI) de Goodwin Proctor.
“La regulación de la investigación y el desarrollo y la vía de registro de biosimilares en China continuará siendo estructuralmente más sólida, clara y transparente en los años previsibles”, dijo Freddy Yip, PCLL, PhD, un abogado con sede en Hong Kong. Según los estándares estadounidenses, una vez no hubo verdaderos biosimilares en China, debido a estándares menores para su aprobación, pero las políticas regulatorias se han endurecido considerablemente.
En 2015, China creó una regulación estandarizada para el desarrollo y evaluación de biosimilares, que Yip y Huiya Wu, JD, describieron como clave para la revolución regulatoria de biosimilares en China. Esto aclaró la definición de biosimilares y estableció estándares para la investigación y el desarrollo preclínicos, los ensayos clínicos y los procesos de fabricación, creando lo que Yip dijo que era la “base” para el crecimiento de la industria de biosimilares de China. Junto con las diversas iniciativas regulatorias, China dio impulso al mercado de productos biológicos al agregar muchos productos biológicos a la lista nacional de medicamentos reembolsados (RDL).
Hasta 2017, esta lista incluía tratamientos de quimioterapia pero no biológicos oncológicos, dijo Yip. “Como resultado, los precios de estos medicamentos disminuyeron significativamente y, a medida que se incluyen más productos biológicos en el RDL, se espera que aumente la asequibilidad de los productos biológicos, lo que permite un mayor acceso al mercado”.
Prioridad por necesidad urgente
El país desde 2018 ha permitido la revisión y aprobación prioritarias de medicamentos que abordan necesidades clínicas urgentes y posibles exenciones de ensayos clínicos para aplicaciones de medicamentos respaldadas por datos clínicos sólidos de ensayos realizados en el extranjero, dijo Yip. En consecuencia, el mercado chino de productos biológicos ha crecido de $ 18 mil millones en 2014 a $ 40 mil millones en 2018, y la proyección es que surja un mercado de $ 99 mil millones para 2023, dijeron los abogados, citando datos de Frost & Sullivan.
Como en los Estados Unidos, el crecimiento del mercado de productos biológicos en China ha eclipsado ampliamente la expansión del mercado de genéricos allí. Yip predijo que en China, donde hay una aceptación mucho mayor que en los Estados Unidos para el uso de marcas de medicamentos no originarias, la tasa de crecimiento de los biosimilares pronto “será mucho mayor” que la de sus medicamentos de referencia.
En los Estados Unidos, el mercado de biosimilares en 2019 fue de $ 737,2 millones frente a $ 354 millones en China. Se proyecta un fuerte crecimiento en ambos mercados, pero “parece que Estados Unidos seguirá siendo el mercado más grande hasta al menos 2027”, dijo Wu. Se necesita más tiempo para obtener un biosimilar a través del proceso de aprobación en Estados Unidos que en China, dijo Wu.
El tiempo de desarrollo en China podría llevar 5 años o más y costar más de 50 millones de dólares, frente a 7 a 8 años y de 75 a 250 millones de dólares en Estados Unidos, estimó. Otra característica clave que define el mercado chino de biosimilares es el dominio de empresas biofarmacéuticas relativamente pequeñas, dijo Wu.
En los Estados Unidos, “en su mayor parte, se trata de grandes empresas farmacéuticas bien establecidas, aunque hay empresas más pequeñas y nuevas, como Coherus BioSciences. También hay una representación bastante sólida de empresas de la República de Corea como Celltrion “.
El mercado de China puede carecer de la representación de estos grandes actores, pero sus empresas de biosimilares tienen la ventaja de las leyes de propiedad intelectual que pueden permitir la entrada más temprana de biosimilares. Este ha sido el caso del adalimumab (referencia, Humira). El primer biosimilar de adalimumab en China fue lanzado en enero de 2020 por Bio-Thera Solutions. Se impide el lanzamiento de los primeros biosimilares de adalimumab en EE. UU. Hasta 2023 debido a acuerdos entre la empresa creadora AbbVie y los desarrolladores de biosimilares.
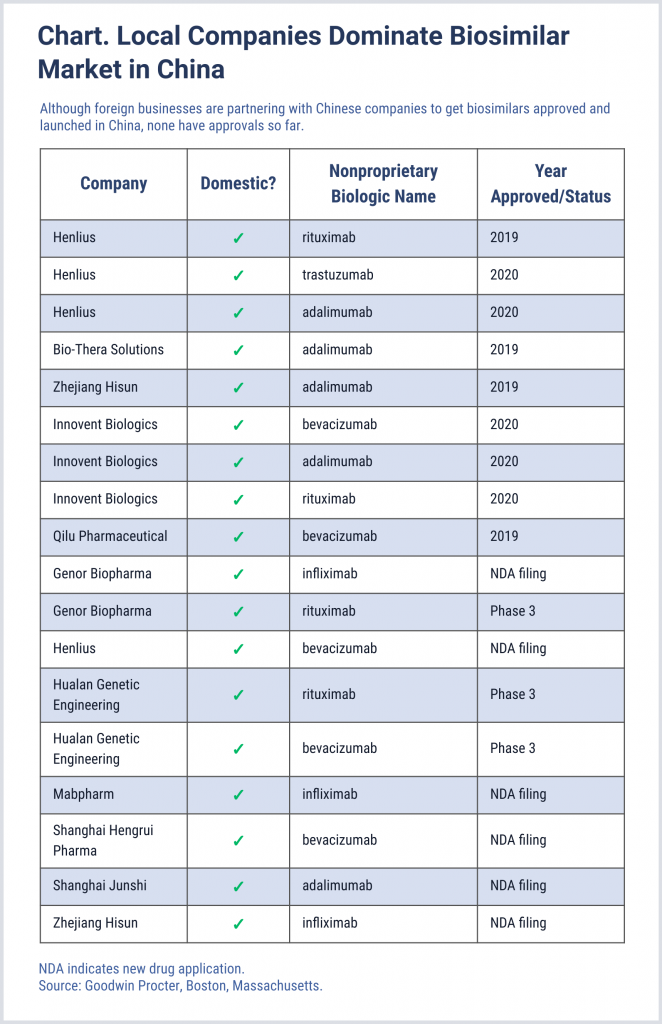
Aunque las empresas con sede en China cuentan con todas las aprobaciones hasta ahora para biosimilares en ese mercado (Gráfico), las empresas externas se están asociando con empresas chinas para obtener la información y el apalancamiento que necesitan para penetrar en ese mercado y obtener una participación en el crecimiento. Esto incluye a Amgen, de Thousand Oaks, California, que ha establecido una colaboración con Simcere, con sede en China; y Samsung Bioepis, una empresa con sede en la República de Corea que trabaja con 3SBio, con sede en China. Celltrion espera construir la que será la instalación de fabricación de productos biológicos más grande de China en Wuhan. Gráfico. Las empresas locales dominan el mercado de biosimilares en China
Tiempos de revisión reducidos
El proceso de aprobación de medicamentos de China se ha acelerado significativamente, explicó Yip. Henlius comenzó el desarrollo preclínico de su biosimilar de rituximab en 2010 y presentó su solicitud de nuevo fármaco en investigación (IND) en 2011 (solicitando permiso para comenzar los ensayos de fase 1 en humanos).
Finalmente recibió la aprobación IND de la Administración Nacional de Productos Médicos (NMPA) en 2014. En 2017, presentó una nueva solicitud de medicamento (NDA) ante la NMPA y recibió la aprobación de la NDA en 2019, convirtiéndose en la primera empresa en obtener una aprobación oficial de biosimilares en China. .
Hoy, ese proceso tomaría sustancialmente menos tiempo, dependiendo de la calidad de la aplicación. “Cada uno de los plazos [desde la solicitud de IND hasta la autorización de comercialización de medicamentos] ahora se mide en días, y el paso más largo toma solo 90 días”, dijo Yip. “Por ejemplo, si un solicitante de IND no recibe ninguna opinión negativa o cuestionadora de la NMPA dentro de los 60 días posteriores a la fecha de aceptación de la solicitud y el pago de la tarifa, se pueden realizar ensayos clínicos de acuerdo con el plan que se ha presentado”.
En 2018 y 2019, el gobierno chino identificó 78 medicamentos prioritarios para los cuales los procesos de aprobación podrían acelerarse y los datos de ensayos clínicos en el extranjero se utilizaron para respaldar las solicitudes. Esto se hizo para alentar a las compañías farmacéuticas a llevar estos medicamentos al mercado lo más rápido posible.
En general, los reguladores chinos requieren ensayos clínicos en el país que demuestren que se ha probado la seguridad y eficacia de los medicamentos en poblaciones chinas. Ahora, “si no hay diferencia étnica en el estudio clínico, los patrocinadores pueden enviar los datos del ensayo clínico obtenidos en el extranjero y solicitar directamente el registro de la lista de medicamentos”, dijo Yip.







