Gamma-Aminobutyric acid, GABA molecule. It is a naturally occurring neurotransmitter with central nervous system inhibitory activity. Structural chemical formula on the dark blue background. Vector illustration
3. Química, fuentes naturales y metabolismo del GABA
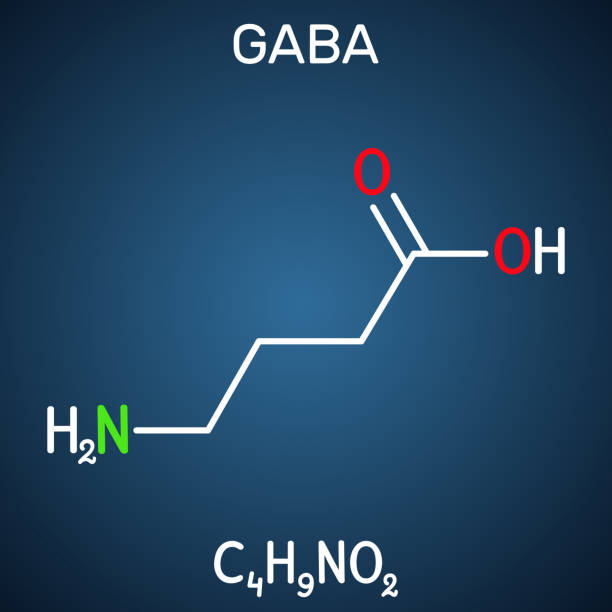
GABA es un aminoácido no proteico de cuatro carbonos, un ácido butanoico con un sustituyente amino ubicado en la posición C-4. La fórmula molecular del GABA es C 4 H 9 NO 2 . El nombre IUPAC es ácido 4-aminobutanoico (Figura 2), el número CAS es 56-12-2 y el número de código UNII es 2ACZ6IPC6I [ 19 ]. El peso molecular es 103,12 g/mol y el punto de fusión es 202 °C. El GABA también se conoce como ácido 4-aminobutanoico, ácido piperídico y ácido piperidínico. Otros identificadores de GABA se pueden encontrar en PubChem [ 20 ]. El GABA es una sustancia cristalina, de color blanco a amarillo claro, y es fácilmente soluble en agua pero insoluble o poco soluble en otros disolventes.

Ácido gamma -aminobutírico (GABA, ácido 4-aminobutírico).
3.1. Fuentes naturales de GABA
El GABA es omnipresente en las plantas, donde se sintetiza principalmente a partir del ácido glutámico a través de la enzima glutamato carboxilasa [ 21 ]. Se ha demostrado que aumenta significativamente en las plantas después de estrés ambiental y de otro tipo, como sequía, aumento de la salinidad, heridas, hipoxia, infección y germinación. Varias plantas comestibles y medicinales contienen GABA en diferentes niveles. Por ejemplo, en el fruto del tomate ( Solanum lycopersicum ), se acumula a medida que el fruto madura hasta la etapa de maduración, cuando se acelera su catabolismo [ 22 ]. Un estudio sobre el contenido de GABA en alimentos crudos seleccionados encontró que algunos contienen cantidades modestas de GABA. El germen de arroz integral (718 nmol/g), los cereales germinados (300-400 nmol/g) y las espinacas (414 nmol/g) tuvieron los niveles más altos de GABA.23 , 24 ]. Otros estudios demostraron hallazgos similares en frijoles germinados o germinados, incluidos los frijoles adzuki ( Vigna angularis (Willd.) Ohwi y H. Ohashi) [ 25 ], altramuz ( Lupinus angustifolius L.) [ 26 ] y soja ( Glycine max L.) [ 27 ] en comparación con los frijoles sin germinar. De manera similar, se ha demostrado que los cereales, como la avena ( Avena sativa L.), el trigo ( Triticum aestivum L.) y la cebada ( Hordeum vulgare L.), contienen GABA [ 28]. En algunos alimentos fermentados, el GABA se encuentra en niveles mucho más altos. Se informa que el kimchi de comida tradicional coreana contiene de 2667 a 7225 nmol de GABA/g [ 29 ], mientras que se ha informado que las hojas de té verde japonés contienen de 9697 a 19,395 nmol de GABA/g en peso/peso [ 30 ]. Otros alimentos fermentados con ácido láctico, como las carnes curadas y los quesos, también contienen altas cantidades de GABA [ 31 ]. Los seres humanos han estado expuestos al GABA en los alimentos fermentados desde que comenzaron a consumirlos.
3.2. Fuentes comerciales de GABA
El GABA se puede producir mediante tres métodos principales: (i) fermentación microbiana, (ii) biocatálisis enzimática y (iii) síntesis química. La fermentación microbiana es el método de fabricación preferido para uso comercial y, aunque las bacterias y los hongos son buenas fuentes de producción de GABA, los géneros de bacterias del ácido láctico se han utilizado más ampliamente para la producción de GABA. En un método de fabricación, la producción comienza con un caldo de fermentación que contiene glutamato monosódico, ácido glutámico, extracto de levadura, glucosa y éster de ácido graso de glicerina en agua. La mezcla se esteriliza y luego se inocula con Lactobacillus hilgardii cepa K-3 y se deja fermentar durante varios días. Posteriormente, el caldo se esteriliza, se somete a varios pasos de filtración y luego se seca por aspersión para formar un polvo [ 11]. Se han presentado varias patentes que describen la producción de GABA mediante fermentación [ 32 , 33 , 34 ]. La fermentación en estado sólido (SSF) es otra estrategia que se ha mostrado prometedora en la producción de GABA. Por ejemplo, la fermentación de Vicia faba por Lactobacillus plantarum VTT E-133328 dio como resultado una producción de 626 mg/kg de GABA [ 35 ].
La producción comercial de GABA mediante biocatálisis enzimática se logra a partir del ácido glutámico después de la descarboxilación en una reacción catalizada por la glutamato descarboxilasa (GAD), con la ayuda de la coenzima piridoxal-5′-fosfato, para formar GABA [11 ] . Sin embargo, debido a la complejidad y el alto costo asociado de la purificación de GAD, así como a las limitaciones en su estabilidad y reutilización, este método de producción no es viable para aplicaciones comerciales [36 , 37 ] .
La síntesis química de GABA se puede lograr mediante varias rutas. En uno de esos métodos, la producción de GABA implica la reacción de carboaminación de alquenos, catalizada por transferencias de complejos de cobre [ 38 ]. Otros métodos son más complejos e incluyen hasta cinco pasos de reacción que generalmente son costosos, producen subproductos no deseados y requieren el uso de reactivos peligrosos, lo que hace que el uso comercial de la síntesis química sea desfavorable [37 ] .
3.3. Metabolismo de GABA
En animales, GABA se sintetiza a partir de glutamato a través de la vía de derivación de GABA ilustrada enfigura 3[ 39 ]. La síntesis es catalizada por la enzima descarboxilasa del ácido L-glutámico (GAD) con la ayuda del fosfato de piridoxal, la forma activa de la vitamina B6, como cofactor. El GABA es metabolizado por la gamma-aminobutirato transaminasa en un metabolito intermedio, el succinato semialdehído, que luego puede reducirse a gamma-hidroxibutirato u oxidarse a succinato y eventualmente convertirse en CO 2 y agua a través del ciclo del ácido cítrico [ 39 ].
En la derivación GABA, el GABA se sintetiza a partir de glutamato en un proceso catalizado por GAD. El GABA es metabolizado por el GABA-T en succinato semialdehído, que luego se reduce a gamma-hidroxibutirato o se oxida a succinato y finalmente se convierte en CO 2 y agua a través del ciclo del TCA. GAD, descarboxilasa del ácido glutamático; GABA-T, GABA transaminasa; SSA, semialdehído succínico; SSA-DH, semialdehído deshidrogenasa succínico; Ciclo TCA, ciclo del ácido tricarboxílico. Verde, enzimas; Naranja, cofactor.
4. Estándares de calidad de la farmacopea para GABA
El anteproyecto de monografía de la USP actualmente en desarrollo define que GABA contiene no menos de (NLT) 98,0 % y no más de (NMT) 102,0 % de ácido gamma-aminobutírico (C 4 H 9 NO 2 ), calculado en base seca. La monografía propone la identificación mediante cromatografía líquida de alto rendimiento (HPLC) infrarroja (IR) en comparación con el estándar de referencia USP para el ácido gamma aminobutírico. Para el ensayo, se propone HPLC para determinar los constituyentes y el criterio de aceptación del 98,0 al 102,0 %. Se propone establecer límites de impureza para cloruro y sulfato, con criterios de aceptación de no más de 0,05% y 0,03%, respectivamente, determinados siguiendo los métodos del Capítulo General de la USPNF ( USPNF GC) <221>Cloruro y Sulfato . Los compuestos relacionados se limitan al 0,5 % para impurezas individuales y no más de 2,0 % para el total de impurezas. Otras pruebas específicas en la monografía son para pH (criterios de aceptación, 6,5–7,5), determinado según USPNF GC <791> pH, y pérdida por secado, según USPNF GC <731> Pérdida por secado con un criterio de aceptación de NMT 0,5 %.
Otras farmacopeas y autoridades sanitarias encuestadas no tenían monografías para GABA (Farmacopea japonesa, Farmacopea europea, Farmacopea internacional de la Organización Mundial de la Salud, Farmacopea británica, Farmacopea de la República Popular China y monografías en la Dirección de productos sanitarios naturales y sin receta de Canadá ( NNHPD)).
5. Estado regulatorio del GABA y niveles de ingesta
En los EE. UU., el GABA como aminoácido cumple con la definición de ingrediente dietético según 201(ff)(1)(D) y está disponible en numerosos productos comercializados como suplementos dietéticos y figura en la lista de la United Natural Products Alliance (UNPA). de ingredientes dietéticos que estaban en el mercado antes de la aprobación de DSHEA en 1994. Aunque la lista de la UNPA no está oficialmente reconocida, la presencia de GABA en esta lista es una indicación de que el GABA puede haber sido utilizado como suplemento dietético antes de su promulgación. de DSHEA en 1994. Al 14 de abril de 2021, la base de datos de etiquetas de suplementos dietéticos (DSLD) contenía 644 productos que tenían GABA en cualquier parte de la etiqueta [ 40 ]. En 2008 y 2015 se presentaron a la FDA dos avisos GRAS (GRN00257 y GRN00595) para su consideración [ 41]. Ambos avisos fueron presentados por la misma empresa y no fueron revisados por la FDA ya que la empresa los retiró poco después de su presentación [ 42 ]. Según la base de datos de Sustancias agregadas a los alimentos de la FDA , el GABA (como ácido 4-aminobutírico) se utiliza para lograr efectos técnicos como agente aromatizante o adyuvante [ 43 ]. De acuerdo con 40 CFR Parte 180: Tolerancia y exenciones para residuos químicos de pesticidas en los alimentos (40 CFR § 180.1188), el GABA está exento del requisito de tolerancia en todos los productos alimenticios cuando se usa de acuerdo con buenas prácticas agrícolas. La Agencia de Protección Ambiental (EPA, Washington, DC, EE. UU.) evaluó el GABA y decidió que cumplía con el requisito legal de certeza razonable de que no causará daños [ 44 ].
En otros países, el GABA está regulado como medicamento o fármaco. En Canadá, el GABA se reconoce como ingrediente medicinal. En abril de 2021 se incluyeron un total de 119 licencias activas de salud natural para productos que contienen GABA como ingrediente medicinal en la base de datos de productos de salud naturales con licencia de Health Canada (LNHPD) [45 ] . En Europa, el GABA es un ingrediente de los complementos alimenticios. En 2009, el Panel de Productos Dietéticos, Nutrición y Alergias de la Autoridad Europea de Seguridad Alimentaria (EFSA) emitió una opinión científica sobre declaraciones de propiedades saludables relacionadas con el GABA y la función cognitiva y concluyó que no se había establecido una relación causa-efecto entre la ingesta de GABA y las funciones cognitivas reivindicadas [ 46]. En Australia, GABA no figura en el Registro Australiano de Productos Terapéuticos (ARTG, Woden [ACT], Australia) y no está permitido su uso en los medicamentos incluidos; Actualmente no se utiliza en ningún producto terapéutico suministrado en Australia. En Nueva Zelanda, un documento de Medsafe menciona al GABA como medicamento controlado B1 según la Ley de uso indebido de drogas de 1975 [ 47 ].
Para determinar los niveles de ingesta de GABA en los suplementos dietéticos, se realizaron búsquedas en varias bases de datos utilizando los términos de búsqueda GABA, ácido gamma-aminobutírico y ácido 4-aminobutanoico. La ingesta recomendada por los fabricantes en la etiqueta proporciona GABA en el rango de 1,5 µg a 3000 mg/día, aunque para la mayoría de los productos, la ingesta recomendada es de 100 mg en dosis divididas por día. La mayoría de los productos enumerados en DSLD llevan declaraciones en la etiqueta que indican que los productos están destinados a adultos mayores de 18 años. Algunos productos incluyen una etiqueta de advertencia que indica que:
Algunas personas pueden experimentar un leve hormigueo en la piel y/o una ligera dificultad para respirar poco después de tomar GABA. Esto es característico de este aminoácido y desaparece rápidamente .
[ 40 ]
La monografía del NNHPD para productos de función cognitiva recomienda una ingesta diaria de 50 a 3000 mg de GABA que no exceda los 750 mg por dosis única; También recomienda consultar a un médico para el uso de productos que proporcionen 300 mg/día o más cuando se utiliza GABA durante más de 4 semanas [ 48 ].
El GABA fue evaluado por el Comité Conjunto FAO/OMS de Expertos en Aditivos Alimentarios (JECFA, Roma, Italia) para determinar su seguridad como aditivo alimentario o contaminante. El comité del JECFA concluyó que los niveles de GABA en los tejidos corporales derivados del consumo de alimentos que contienen GABA como agente aromatizante serían biológicamente insignificantes (en la población estadounidense, estimados en 0,1 µg/día) y, por lo tanto, no representarían ningún problema de seguridad [ 49 ].
6. Evidencia clínica de la seguridad del GABA
6.1. Estudios clínicos
No se identificaron estudios diseñados específicamente para evaluar la seguridad y tolerabilidad del GABA. Sin embargo, el GABA se ha estudiado ampliamente en estudios clínicos para diferentes aplicaciones, incluido el tratamiento del insomnio, la presión arterial alta y el estrés, y como sustancia ergogénica para aumentar la hormona del crecimiento (GH). Examinamos algunos de estos estudios que contenían información relevante para la seguridad como parte de la revisión integral del GABA de la USP.
Numerosos estudios han examinado el efecto de la suplementación con GABA en suplementos dietéticos o en alimentos funcionales (por ejemplo, estudios sobre GABA en polvo en cápsulas, agregado al arroz o producido naturalmente en leche fermentada o soja fermentada). La mayoría de estos estudios examinaron el efecto del GABA sobre la hipertensión leve [ 50 , 51 , 52 , 53 , 54 , 55 , 56 , 57 , 58 , 59 , 60 , 61 , 62 , 63 , 64 , 65]. En total, se identificaron 16 estudios que investigaron el efecto del GABA administrado por vía oral como suplemento o en matrices complejas (como leche fermentada y salsa de soja) sobre la presión arterial alta, para aliviar el estrés o mejorar el sueño. El GABA se probó en dosis que oscilaron entre 0,25 mg y 18.000 mg/día durante períodos de 4 a 12 semanas. Algunos estudios también investigaron el efecto de una sola ingesta de GABA [ 52 , 65 , 66 , 67 , 68 , 69 , 70 , 71 , 72 , 73]. Todos los estudios informaron que el GABA no se asoció con ningún efecto adverso grave, aunque el GABA se asoció con una caída moderada y transitoria (cambio <10%) en la presión arterial (PA). La presión arterial volvió a los valores iniciales unos días después de que los participantes dejaran de tomar GABA, como se describe a continuación.
6.2. Efectos del GABA sobre la presión arterial
Un estudio de diseño paralelo, doble ciego, controlado con placebo examinó la tolerabilidad de los alimentos enriquecidos con GABA en 177 hombres y mujeres hipertensos que no estaban recibiendo tratamiento para la hipertensión [74 ] . Los participantes fueron asignados al azar para recibir 8 ml de uno de los siguientes: salsa de soja baja en sal que contenía 120 mg de GABA, salsa de soja baja en sal (control) o salsa de soja normal (control), diariamente cada uno durante 12 semanas. Al final del estudio, la presión arterial sistólica (PAS) promedio fue menor en 4,6 mm Hg ( p< 0,05) en el grupo tratado con GABA en comparación con los grupos de control. La presión arterial diastólica (PAD) no cambió en todos los grupos de tratamiento, y la PA promedio estuvo por encima de lo normal en todos los grupos al final del estudio sin diferencias entre los grupos. Además, se observaron cambios significativos en la lactato deshidrogenasa (LDH), albúmina, nitrógeno ureico y calcio, aunque los cambios estuvieron por debajo de una diferencia del 10 % y se consideraron dentro del rango de referencia histórico y, por lo tanto, clínicamente irrelevantes. La incidencia de efectos adversos fue similar entre los grupos y no se consideraron debido al GABA [ 74 ].
Un ensayo aleatorizado, controlado con placebo y ciego a las señales investigó los efectos de un producto lácteo fermentado que contiene GABA (FMG) sobre la presión arterial en 39 pacientes con hipertensión leve [62 ] . Las pacientes recibieron 100 ml de MGF al día que contenían entre 10 y 12 mg de GABA durante 12 semanas o 100 ml de placebo durante 12 semanas, seguido de 2 semanas sin ingesta. El placebo fue una mezcla de ácido L-láctico y edulcorantes añadidos a la leche desnatada para imitar el sabor de la mutilación genital femenina. Se observó una disminución significativa de la PA en las semanas 2 a 4 en los grupos de MGF, y la PA se mantuvo baja durante el período de 12 semanas. En el grupo tratado con mutilación genital femenina, la PA disminuyó 17,4 mm Hg para la PAS y 7,2 mm Hg para la PAD y fue significativamente diferente del valor inicial ( p <0,01) y del grupo de placebo ( p< 0,01). Las mediciones de frecuencia cardíaca, peso corporal, variables hematológicas y químicas sanguíneas, glucosuria y proteinuria estuvieron dentro del rango histórico normal en todos los grupos de tratamiento. Aunque ninguno de los pacientes informó efectos secundarios, cuatro pacientes del grupo de MGF abandonaron el estudio: dos por motivos personales, uno que usó un medicamento antihipertensivo y otro que desarrolló úlceras estomacales leves que no se consideraron debido a la ingesta de MGF [62 ] . .
En un estudio doble ciego controlado con placebo, se estudió el efecto de la leche fermentada que contenía GABA (preparada con L. casei y L. lactis) en 86 sujetos sanos con hipertensión leve o moderada [ 63]. Los participantes recibieron 100 ml de leche en polvo desnatada (formulada para contener una cantidad similar de ácido láctico a la leche que contiene GABA) o leche fermentada que proporciona 10 mg de GABA al día (0,15 mg/kg de peso corporal/día) todas las mañanas durante 12 semanas. . Los participantes fueron evaluados clínicamente y entrevistados, y las siguientes variables se determinaron a intervalos: peso, índice de masa corporal (IMC), presión arterial, frecuencia cardíaca, índices de orina y química clínica y hematología sanguínea estándar. Todos los parámetros fueron normales excepto la PA, que permaneció ligeramente elevada en ambos grupos; sin embargo, las presiones arteriales sistólica y diastólica promedio fueron leve pero significativamente mayores en el grupo de GABA en aproximadamente un 5 % ( p < 0,01) en comparación con los controles. No se informaron efectos adversos relacionados con GABA [ 63].
En un segundo ensayo aleatorizado, doble ciego y controlado con placebo, Kajimoto et al. [ 64 ] evaluaron los efectos del GABA en 108 hombres y mujeres sanos con presión arterial normal alta (42 hombres y 66 mujeres). La edad promedio fue de 46,4 ± 1,7 y 47,1 ± 1,7 años y el peso fue de 62 ± 1,4 y 61,3 ± 1,3 kg en los grupos de prueba y placebo, respectivamente [64 ] . Los participantes recibieron 100 ml de placebo o de la misma leche fermentada descrita anteriormente por Kajimoto et al. [ 63], proporcionando aproximadamente 12,3 mg de GABA/día cada mañana durante las 12 semanas de la fase de suplementación del estudio. Se evaluó a los participantes para detectar cambios en el peso y el IMC, y se determinaron química clínica estándar, hematología, análisis de orina y presión arterial una semana antes de comenzar el estudio, al final del estudio y a intervalos durante el estudio. Las mediciones de PA en el grupo de suplementación con GABA estuvieron por encima de lo normal durante todo el estudio en ambos grupos, pero la PAS y la PAD promedio disminuyeron ~7% ( p < 0,05). Todas las demás mediciones fueron anodinas y similares en los grupos tratados con placebo y con GABA, y no se observaron efectos secundarios relacionados con GABA durante el estudio [ 64 ].
En un tercer estudio, Kajimoto et al. [ 64 ] investigaron el uso suplementario de GABA en 88 sujetos hipertensos pero por lo demás sanos (31 hombres y 57 mujeres; 53,8 ± 8,5 y 54,7 ± 8,6 años y con un peso de 59,7 ± 10,1 y 58,8 ± 9,2 kg para los grupos de prueba y placebo, respectivamente) utilizando un diseño de estudio aleatorizado, doble ciego, controlado con placebo y de grupos paralelos [ 64]. Después de un período de observación de 2 semanas, los sujetos fueron asignados aleatoriamente para recibir cuatro placebo o cuatro tabletas de GABA (Otsuka Pharmaceutical Co., Tokio, Japón; 20 mg de GABA/tableta) diariamente durante un período de 12 semanas, lo que resultó en 0 o 80 mg GABA/día. También se incluyó en el ensayo un período de observación posterior al estudio de 4 semanas. Se midieron la presión arterial y el peso corporal, y se realizaron análisis de sangre (química clínica, incluidos niveles plasmáticos de GABA y hematología) y orina [ 64 ]. Al igual que en estudios anteriores, los niveles plasmáticos de GABA no aumentaron significativamente en relación con los controles después de 12 semanas de consumir GABA en una dosis de 80 mg/día. Se observó un cambio significativo pero transitorio en la PA (-5%; p< 0,01) en sujetos que recibieron GABA en comparación con aquellos en el grupo de placebo. Aunque algunos valores de química clínica disminuyeron en el grupo de GABA, todos los valores estuvieron dentro de los rangos de control históricos y se consideraron clínicamente irrelevantes. Los hallazgos del análisis de orina se consideraron normales. Ninguno de los sujetos informó efectos adversos específicos de GABA, y el estudio no consideró ninguno de los síntomas informados (resfriado, dolor de cabeza, diarrea, heces blandas, enfermedad mano-pie-boca en un paciente, picazón o sarpullido). investigador(es) relacionados con la administración de GABA.
Otro estudio investigó la tolerabilidad de la suplementación con GABA en adultos levemente hipertensos pero por lo demás sanos [ 61]. Los autores primero establecieron una dosis óptima en sujetos levemente hipertensos (PAS entre 130 y 180 mm Hg) que fueron aleatorizados para recibir dosis orales de GABA de 0 (placebo), 20, 40 u 80 mg/día durante 4 semanas. Los hallazgos hematológicos, de química clínica y de análisis de orina no fueron notables después de 4 semanas de suplementación con GABA, y las mediciones de los parámetros estándar relacionados con la seguridad no fueron notables en todas las dosis. Una ingesta de 80 mg/día de GABA se asoció con una reducción significativa de la PA en adultos con hipertensión leve y no se informaron efectos adversos. Un estudio posterior evaluó los efectos a largo plazo de GABA a 80 mg diarios versus placebo en sujetos levemente hipertensos durante 8 semanas. Al final del estudio de 8 semanas, la PAS y la PAD eran en promedio un 5% más bajas ( p.<0,05) en todos los sujetos que recibieron 80 mg/día de GABA en comparación con los participantes en el grupo de placebo cuyos niveles de PA se mantuvieron por encima de lo normal [ 61 ].
6.3. Efectos del GABA sobre los niveles de la hormona del crecimiento
Se ha informado que el GABA aumenta los niveles séricos de GH y se ha considerado una ayuda ergogénica. Muchos suplementos deportivos incluyen GABA como ingrediente.
Tres estudios de Cavagnini et al. publicado en 1980 y 1982 evaluó el efecto de la suplementación de alto nivel con GABA oral como una dosis única de 5 g sobre los niveles de GH en nueve mujeres [67 ] . En un estudio, el nivel plasmático de GABA se elevó significativamente ( p < 0,0001) en comparación con el nivel en sujetos a los que se les administró un antagonista de GABA antes de tomar GABA. El nivel de prolactina no se vio afectado en el grupo al que se le administró solo GABA. Los autores informaron que algunos de los participantes que tomaron una dosis única alta de GABA experimentaron una ligera sensación de ardor en la garganta que en algunos casos iba acompañada de dificultad para respirar. Esto fue transitorio y se resolvió sin tratamiento, aunque no se indica la duración del efecto [ 67]. El segundo estudio de Cavagnini et al. administró una dosis única de 5 g de GABA disuelta en 150 ml de agua del grifo a 19 participantes (2 hombres y 17 mujeres) y 150 ml de agua del grifo como placebo a 18 participantes (1 hombre y 17 mujeres). Para una prueba de tolerancia a la insulina, a ocho mujeres participantes se les administraron 18 g de GABA en cuatro dosis divididas al día durante 4 días, y la última dosis se administró una hora antes de la prueba de tolerancia a la insulina posterior al estudio [66 ] . La dosis de 5 g de GABA se asoció con aumentos significativos en los niveles de GH ( p.< 0,0001) hasta más de 5 ng/ml. Nuevamente, algunos participantes informaron una sensación de ardor en la garganta inmediatamente después de ingerir GABA y, en algunos casos, esto fue acompañado de dificultad para respirar, que volvió a la normalidad poco después. Algunos participantes también informaron letargo y debilidad en las piernas. En el grupo que recibió 18 g de GABA durante 4 días, hubo una reducción significativa ( p < 0,01) de la liberación general de GH, pero el nivel de prolactina aumentó significativamente en respuesta a la prueba de hipoglucemia de insulina. En todos los demás grupos, no hubo ningún efecto sobre los niveles de prolactina, la frecuencia del pulso, la presión arterial o la concentración inicial de glucosa en sangre [ 66 ].
En un tercer estudio, Cavagnini et al. [ 50 ] investigó el efecto potencial de GABA sobre la función pancreática. Doce individuos sanos (tres hombres, nueve mujeres) se dividieron en tres grupos, y cada grupo recibió tres dosis de placebo o 5 go 10 g de GABA disuelto en agua. Las tres dosis se administraron en días separados, con 2 a 3 días de diferencia. Después de la administración de GABA, se determinaron los niveles plasmáticos de insulina inmunorreactiva (IRI), péptido C (CP), glucagón inmunorreactivo (IRG) y glucosa. Hubo importantes ( p< 0,001) aumentos en IRI, CP e IRG en el grupo que recibió 5 go 10 g de GABA, aunque el efecto fue transitorio y volvió al valor inicial en 180 minutos. No hubo cambios en los niveles de glucosa en sangre después del consumo de GABA y todos los participantes del grupo de GABA completaron el estudio. No hubo informes sobre efectos secundarios después de la administración de GABA [ 50 ]. Otro estudio de los efectos del GABA en hombres entrenados en resistencia mostró que una ingesta de 3 g se asociaba con concentraciones aproximadamente un 400 % más altas de GH inmunoactiva e inmunofuncional. La ingesta de GABA combinada con ejercicio de resistencia se asoció con niveles de GH inmunoactivos un 200% más altos y niveles de GH inmunofuncionales un 175% más altos en comparación con el ejercicio de resistencia solo. No se mencionaron efectos adversos para este estudio [ 58].
6.4. Efecto del GABA sobre el sueño y el estrés
Un ensayo prospectivo, aleatorizado, doble ciego y controlado con placebo evaluó los efectos del GABA extraído del germen de arroz sin pulir para mejorar la calidad del sueño en 40 pacientes con insomnio [59 ] . Los participantes tomaron 300 mg de GABA o 300 mg de maltodextrina (placebo) al día durante 4 semanas. La dosis de 300 mg se seleccionó basándose en un estudio anterior en el que los pacientes informaron que su insomnio subjetivo mejoró más con 300 mg de GABA en comparación con 150 mg [ 75 ]. Los participantes completaron un cuestionario de sueño y se sometieron a una polisomnografía antes y después del estudio. Después de 4 semanas de suplementación con GABA, la latencia del sueño disminuyó significativamente ( p = 0,001) y la eficacia del sueño aumentó significativamente ( p= 0,018) en comparación con placebo. Tres de cada 10 sujetos que recibieron GABA tuvieron malestar abdominal, dolor de cabeza o somnolencia, que se clasificaron como leves a moderados. Los autores concluyeron que la suplementación con GABA puede mejorar la calidad del sueño sin efectos adversos graves [ 59 ].
En un estudio que evaluó los efectos del GABA sobre la variabilidad de la frecuencia cardíaca y el estrés, no se mencionaron efectos adversos o indeseables en voluntarios sanos que recibieron un té oolong enriquecido con GABA (2,01 mg de GABA por 200 ml de té, según lo analizado mediante HPLC). . El consumo de té enriquecido con GABA se asoció con una mejor variabilidad de la frecuencia cardíaca y una disminución significativa en la puntuación de estrés inmediato en comparación con los voluntarios que recibieron té regular (no enriquecido con GABA). No se informó que los eventos adversos estuvieran monitoreados en este estudio, y los autores recomendaron que se investigue la seguridad y tolerabilidad de la ingesta de GABA en estudios futuros [ 68 ].
6.5. Otros estudios
Un estudio controlado con placebo evaluó los efectos de Laminaria japonica sobre la memoria a corto plazo y la aptitud física, y no se mencionaron efectos secundarios en voluntarios de edad avanzada que recibieron 1,5 g/día de Laminaria japonica fermentada durante 6 semanas. El contenido medio de GABA en Laminaria japonica fermentada fue de 54,5 mg/g, proporcionando una ingesta de aproximadamente 81,75 mg/día de GABA. Aunque se controlaron las reacciones adversas, no se mencionó ningún efecto adverso ocurrido durante el estudio [ 76 ].
Un ensayo clínico propuesto para evaluar la seguridad de la suplementación con GABA en pacientes con diabetes mellitus tipo I de larga duración figura en el sitio web NIH Clinicaltrials.gov (Identificador: NCT03635437 ). El objetivo del ensayo propuesto es encontrar un tratamiento razonablemente seguro y tolerable en adultos con diabetes tipo I que restablezca parte de la secreción endógena de insulina, mejore la calidad de vida y reduzca el riesgo de complicaciones tanto a corto como a largo plazo. Los niveles de ingesta propuestos en el ensayo son 200 o 600 mg/día de GABA durante 6 meses y 600 mg/día de GABA combinado con 0,5 mg/día de alprazolam oral durante 3 meses seguido de 600 mg/día de GABA solo durante otros 3 meses. meses. El ensayo se encuentra actualmente en la fase de reclutamiento [ 77 ].
La biblioteca Cochrane no produjo ningún artículo relevante para los términos de búsqueda “GABA” o “ácido gamma-aminobutírico” [ 78 ]. Los artículos recuperados trataban sobre pregabalina y gabapentina.
6.6. Eventos adversos asociados con la ingesta de GABA
Los estudios clínicos revisados anteriormente no asociaron ningún evento adverso grave con la ingesta de GABA. Algunos efectos adversos que se informaron después de la ingesta de GABA incluyeron malestar abdominal, dolor de cabeza, somnolencia y sensación transitoria de ardor en la garganta; Estos efectos se clasificaron como leves a moderados [ 50 , 59 , 61 , 67 , 75 ]. No se encontraron en la literatura informes de casos de EA asociados con GABA. Se realizaron búsquedas en varios portales de informes gubernamentales como se describe a continuación.
Una búsqueda en la base de datos pública de la FDA (CAERS) utilizando los términos “GABA” y “ácido gamma-aminobutírico” arrojó 292 AER y 156 AER, respectivamente, que incluían duplicados. De ellos, 151 (97%) se asociaron con DS de múltiples ingredientes y solo el 3% se asociaron con productos de un solo ingrediente. Los efectos adversos informados en los AER de un solo ingrediente fueron todos diferentes. La asignación de causalidad no fue posible debido a la limitada información disponible.
Una búsqueda en el Programa de Vigilancia de Canadá [ 79] base de datos de acceso público arrojó un EA grave espontáneo en un hombre de 23 años que había estado tomando 500 mg de GABA por vía oral durante 247 días. El paciente presentó ansiedad, trastorno del equilibrio, depresión, hiperhidrosis, insomnio, cambios de humor, parestesia, ideación autolesiva, pensamiento anormal y síndrome de abstinencia. El paciente estaba tomando simultáneamente 5-hidroxitriptófano, que también se consideró sospechoso, y tableta de liberación prolongada del complejo B 100 y Hair Force (un producto de múltiples ingredientes); todos fueron considerados medicamentos concomitantes. Debido a que el paciente estaba usando otros productos sospechosos, el papel del GABA, si lo hubiera, en los efectos adversos es incierto. Búsquedas en otras bases de datos públicas, incluida la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA, Londres, Reino Unido) y la Administración de Productos Terapéuticos de Australia (TGA) [80 ] no arrojó informes.
7. Toxicología animal y estudios in vitro
7.1. Estudios de toxicidad aguda
Los Laboratorios de Investigación de Alimentos de Japón (JFRL) [ 81 ] llevaron a cabo un estudio de toxicidad de dosis única en ratas macho y hembra de 4 semanas de edad (10/sexo/grupo). El material de prueba contenía 80% de GABA puro (denominado GABA-80) y se diluyó 4 veces con dextrosa para obtener 20% de GABA (denominado GABA-20). A las ratas se les administró GABA-20 disuelto como una dosis única en agua para proporcionar 5000 mg/kg de peso corporal de GABA-20, lo que correspondería a una exposición aguda a GABA de 1000 mg/kg de peso corporal. El grupo de control, no tratado, recibió agua. Las ratas fueron monitoreadas para detectar signos clínicos y mortalidad durante 14 días. No se produjeron signos clínicos ni muertes, y no se observaron diferencias en el peso corporal durante todo el estudio en las ratas tratadas en comparación con los controles. Como no hubo evidencia de morbilidad ni muertes, el LD 50para GABA-20 se consideró >5000 mg/kg de peso corporal (o aproximadamente >1000 mg de GABA/kg de peso corporal). Estudios anteriores habían informado valores más altos de LD 50 oral de 12.000 mg de GABA/kg en ratones [ 82 ].
7.2. Estudios de toxicidad subcrónica
La Asociación Científica de Alimentos de Japón realizó un estudio de toxicidad de 28 días en ratas Wistar machos y hembras (Hayami et al., 2005). El artículo de prueba era GABA-20 que contenía 20% de GABA, idéntico al material que se utilizó en el estudio de toxicidad aguda de JFRL (2002) [ 81]. Se alimentaron ratas (32 días de edad, 20 de cada sexo por grupo) con comida simple o con comida suplementada con 1% de GABA-20 (que proporciona aproximadamente 1000 mg de GABA-20/kg de peso corporal/día, correspondientes a aproximadamente 200 mg de GABA/kg de peso corporal). peso/día). Se monitoreó a las ratas para detectar signos clínicos, aumento de peso corporal y consumo de alimentos. Al final del estudio, se realizaron pruebas hematológicas y bioquímicas, patología macroscópica estándar y medición del peso de los órganos. Se realizó un examen histopatológico del cerebro, corazón, hígado, riñón, testículos y ovarios. No hubo diferencias significativas entre los grupos de tratamiento y control en el aumento de peso y el consumo promedio de alimentos. No se observaron signos de morbilidad y no se informó mortalidad. No hubo cambios notables en histopatología, hematología, o parámetros bioquímicos en los animales tratados en relación con los controles, y la necropsia no mostró anomalías. La única diferencia significativa en el peso de los órganos fue el peso absoluto y relativo de los testículos, que aumentaron en comparación con el valor inicial tanto en las ratas control como en las tratadas en un 7% y un 6%.p < 0,05), respectivamente. Sin embargo, los autores consideraron que este aumento era toxicológicamente insignificante ya que estaban dentro del rango de datos históricos [ 83 ].
En un estudio de toxicidad de 90 días se administró GABA mediante sonda oral en dosis de 500, 1250 y 2500 mg/kg de peso corporal a grupos de 10 ratas Sprague-Dawley machos y 10 hembras durante 13 semanas. Los datos recopilados incluyeron parámetros clínicos, peso corporal, consumo de alimentos, oftalmología, hematología, química sanguínea y análisis de orina; Se realizó necropsia completa incluyendo determinación del peso de los órganos. GABA fue bien tolerado y no se produjeron muertes que pudieran atribuirse al material de prueba. Los efectos secundarios observados incluyeron diarrea leve en cinco machos y una hembra entre las ratas a las que se les administró 2500 mg/kg/día, y hubo salivación temporal inmediatamente después de la administración en ocho machos y siete hembras en el grupo de dosis alta, que se resolvió sin intervención. Un macho del grupo de 1250 mg/kg/día fue encontrado muerto el día 88; sin embargo, la muerte se consideró aleatoria y no relacionada con la administración de GABA ya que no se observaron cambios histopatológicos en la necropsia. Unos pocos machos mostraron cambios significativos en el aumento de peso corporal; sin embargo, no hubo relación dosis-respuesta y, por tanto, los cambios se atribuyeron a la ingesta de alimentos. El peso de los órganos fue similar entre los grupos y los resultados de los exámenes histopatológicos no fueron notables. Los autores concluyeron que la administración oral de GABA de hasta 2500 mg/kg fue bien tolerada. Observaron que los cambios menores observados en algunos hombres en los signos clínicos, hematología, química clínica e histopatología estaban dentro de los rangos históricos y no dependían de la dosis y, por lo tanto, no se consideraban toxicológicamente significativos. No se observaron cambios en las mujeres.84 ].
Una revisión realizada por la EPA indicó que los estudios en la literatura que involucran la administración crónica prolongada de grandes dosis de GABA a ratas y perros (hasta 1 g/kg/día) no informaron signos de toxicidad o efectos adversos ((Registro Federal Volumen 62, Número 209 (miércoles 29 de octubre de 1997)).
Un estudio encontró que la dosis oral de 25, 50 o 75 mg/kg/día de GABA durante 14 días mejoró el hipotiroidismo inducido por fluoruro en ratones Kumning macho (ratones hipotiroideos) [ 85]. La terapia con hormona tiroidea a largo plazo a menudo se asocia con efectos secundarios en el corazón en pacientes con hipotiroidismo, pero el tratamiento con GABA oral no tuvo efectos secundarios en el miocardio de los ratones hipotiroideos en comparación con los ratones hipotiroideos de control negativo (sin tratamiento con GABA) y los ratones hipotiroideos de control positivo. (tratado con medicación tiroidea no especificada durante 14 días). Tanto el grupo de control negativo como el positivo mostraron hallazgos histopatológicos en el miocardio que consisten en disposición irregular y ruptura de las fibras miocárdicas junto con picnosis e hinchazón nucleares, mientras que los ratones hipotiroideos tratados con GABA mostraron fibras miocárdicas dispuestas normalmente con disminución de la hinchazón y picnosis de los núcleos [85 ] .
7.3. Genotoxicidad
Una prueba de reparación de ADN realizada en las cepas de Bacillus subtilis H17 (Rec+) y M45 (Rec−), examinó la mutagenicidad de dos productos de fermentación que contienen GABA en concentraciones superiores a 10 y 25 mg de GABA por 100 ml. Se llevaron a cabo un estudio de búsqueda de rango de dosis y estudios principales con o sin activación metabólica utilizando S9. Ambos productos no mostraron ningún daño en el ADN en todos los estudios en presencia o ausencia de la mezcla S9. Se incluyó un control negativo (solución salina) que no mostró daños en el ADN, mientras que el control positivo (2-aminoantraceno (2-AA) y 2-(2-furil)-3-(5-nitro-2-furil)-acrilamida (AF-2)), como se esperaba, mostró capacidad mutagénica [ 86 ].
7.4. Efectos reproductivos del GABA
No se encontraron estudios de toxicidad reproductiva o del desarrollo para GABA. Sin embargo, los estudios in vitro demostraron que el GABA puede estar involucrado en el proceso de fertilización al mejorar la capacitación de los espermatozoides, modular los trofoblastos de la placenta y estimular la producción de andrógenos. Un estudio in vitro de los efectos del GABA sobre la motilidad y la hiperactivación del esperma humano determinó que el GABA aumentaba los parámetros cinemáticos y la hiperactivación del esperma, similar a los efectos de la progesterona en el esperma humano. El efecto del GABA y la progesterona juntos no fue diferente de sus efectos por separado, y sus efectos fueron bloqueados por la bicuculina, un antagonista del receptor GABA A [ 87 ].
En un experimento en el que se incubó semen de carneros merino australianos con GABA en diversas concentraciones que oscilaban entre 1 y 20 µM, se observó una capacitación marginal de los espermatozoides a 1 µM, que aumentó hasta una capacitación máxima a 20 µM. Experimentos adicionales demostraron que la incubación de semen de carnero con 1 µM de GABA y el esteroide alopregnanolona, un modificador alostérico del receptor GABA A , dio como resultado un aumento significativo en la capacitación del esperma similar al observado con 20 µM, lo que indica que el efecto de capacitación de GABA es mediado a través de un mecanismo mediado por el receptor GABA A [ 88 ].
En otros estudios, se demostró que el GABA estimula reacciones acrosómicas en espermatozoides humanos precapacitados de una manera dependiente de la concentración. El efecto dependía de la disponibilidad de Ca21 extracelular porque la inclusión de EGTA o La31, un agonista del canal de Ca21, impedía las reacciones acrosómicas inducidas por GABA [ 89 ]. De manera similar, en los espermatozoides de ratón, el GABA promovió la reacción acrosómica y el efecto fue suprimido por el agonista del receptor GABA A. Además, GABA facilitó la fosforilación de tirosina de las proteínas del esperma, un índice de capacitación de los espermatozoides [ 90]. Los efectos del GABA al capacitar a los espermatozoides y estimular las reacciones acrosómicas son importantes, ya que estas actividades facilitan la fertilización. Los espermatozoides de los mamíferos experimentan una reacción acrosómica en respuesta a los agonistas de los ovocitos, un proceso esencial que resulta en la liberación de enzimas necesarias para que los espermatozoides penetren la envoltura del óvulo, lo que permite que los espermatozoides se fusionen con la membrana plasmática del ovocito después de la penetración de la zona pelúcida. [ 91 ]. Otros experimentos han demostrado que GABA regula la biosíntesis de hCG en la placenta humana del primer trimestre actuando a través de receptores similares a GABA A [ 92 ].
Finalmente, un estudio in vitro utilizando testículos de rata obtenidos en diferentes etapas de maduración sugirió que el GABA desempeña un papel fisiológico en la regulación de la producción de andrógenos testiculares de rata, aunque esto puede depender de la etapa de maduración sexual. GABA en una concentración de 10 −6 modificó la producción de andrógenos basal y estimulada por hCG en testículos obtenidos de ratas adultas (60 días), púberes (45 días) y prepúberes (31 días). Sin embargo, los testículos prepuberales expuestos a la misma concentración de GABA (10-6 ) mostraron efectos estimulantes mucho menores sobre la hCG y un aumento significativo en la producción de androstanodiol [ 93 ].
8. Farmacocinética de GABA
Debido a su importancia como neurotransmisor, el metabolismo del GABA se ha caracterizado bien en humanos y animales [ 39 , 94 , 95 , 96 ]. Se considera que el hígado es el sitio metabólico principal para el GABA extracerebral, y las ratas muestran una gran capacidad para la captación de GABA por este órgano [ 97 , 98]. Algunos estudios en animales han demostrado que la dosificación oral no aumenta significativamente los niveles plasmáticos de GABA. En un estudio en ratas, después de una administración oral única de 500 mg de GABA por kg de peso corporal, el nivel plasmático de GABA se mantuvo en aproximadamente 1,6 µM/mL (similar al valor inicial) cuando se midió inmediatamente después de la administración oral y 120 minutos después. Otros estudios informaron que después de la administración intraperitoneal de 500 mg de GABA por kg de peso corporal, los niveles plasmáticos aumentaron a aproximadamente 400.000 µM/ml y disminuyeron progresivamente a 1,2 µM/ml después de 120 minutos. Esto podría ser una indicación de que en roedores, la absorción y/o biodisponibilidad del GABA administrado por vía oral es muy baja. Se demostró que el GABA se elimina rápidamente con una vida media de aproximadamente 20 minutos en ratas, conejos y gatos después de la administración oral.97 ]. Otros estudios han demostrado que después de la administración sistémica en ratas y ratones, el GABA se distribuye principalmente en el hígado, los riñones y los músculos. En el ratón, se detectaron cantidades significativas de GABA en la vejiga urinaria, la pared gastrointestinal, la glándula pituitaria y el cartílago de la columna, las costillas y la tráquea [97 , 98 ] . En ninguno de los estudios revisados se informó evidencia de bioacumulación de GABA o retención específica de órganos.
La absorción de GABA por el intestino está mediada por proteínas portadoras que normalmente participan en la absorción de nutrientes y parece implicar el cotransporte de H + /GABA zwitteriónico [ 99 ]. Los estudios que utilizan intestino de rata sugieren que el GABA comparte un transportador con la β-alanina [ 100 ]. Esto puede explicar por qué hay muy poco GABA biodisponible cuando se ingiere por vía oral. El catabolismo del GABA se produce exclusivamente a través de la GABA transaminasa, durante la cual el GABA se convierte en el metabolito succinato semialdehído. Luego, este puede reducirse a gamma-hidroxibutirato u oxidarse a succinato y, finalmente, convertirse en CO2 y agua mediante el ciclo del ácido cítrico (ciclo de Krebs). Por lo tanto, el GABA se utiliza esencialmente como fuente de energía en el cuerpo y se metaboliza en compuestos inocuos.
En un estudio clínico abierto de tres períodos en el que los participantes ingirieron 2 g de GABA una vez y 2 g de GABA tres veces al día durante 7 días, con un período de lavado de 7 días entre períodos, el GABA se absorbió rápidamente (T máx: 0,5 ) . ~1 h) con una vida media de 5 h. No se observó acumulación de GABA después de administraciones orales repetidas [ 101 ]. Los participantes que recibieron dosis repetidas de GABA mostraron una mayor incidencia de eventos adversos menores, como dolor de garganta, ardor de garganta, sensación de ardor en la piel, dolor de cabeza y mareos. Sin embargo, no hubo cambios clínicamente relevantes en todos los participantes en los signos vitales, parámetro EGCG, examen físico, hematología, bioquímica y análisis de orina. No se observaron eventos adversos graves.
Debido a que el GABA es un neurotransmisor clave en el SNC, es importante comprender qué cantidad de la cantidad administrada puede atravesar la barrera hematoencefálica (BHE) cuando se ingiere por vía oral como suplemento dietético. Hasta ahora, la evidencia indica que cantidades muy bajas de GABA pasan del plasma al cerebro a través de la BHE incluso cuando el GABA se administra de forma exógena por vía oral o intravenosa [97 , 98 , 102 , 103 , 104 , 105 , 106 , 107 , 108 ] .
En un estudio con ratas, aumentar la administración de GABA (por vía intraperitoneal) 1250 veces resultó en un aumento de sólo 30 veces en los niveles de GABA en el líquido cefalorraquídeo (LCR). En otros estudios, un aumento en las concentraciones plasmáticas no se asoció con un aumento en las tasas de permeación de GABA en la BHE de ratas [ 105 ]. La ausencia de una relación dosis-respuesta entre la dosis administrada de GABA y los niveles de GABA en el cerebro puede explicarse parcialmente por los hallazgos de un estudio de Kakee et al. (2001) que muestran que la tasa de salida de GABA a través de la BHE de ratas excedió la entrada en aproximadamente 16 veces [ 109 ] y otros estudios indican que la GABA transaminasa puede degradar rápidamente cantidades muy grandes de GABA cuando se administra por vía intracerebral, disminuyendo así los niveles plasmáticos [102 ]. Parece haber un mecanismo de regulación interno que mantiene el equilibrio de los niveles plasmáticos de GABA independientemente de si se administra GABA externo.
9. Posibles interacciones de GABA con drogas
Algunos estudios clínicos [ 57 , 110 , 111 ] y experimentos con animales [ 110 , 112 , 113 , 114 ] han demostrado que la ingestión de GABA puede provocar una caída de la presión arterial y, por lo tanto, es concebible que el GABA pueda interactuar con medicamentos antihipertensivos, como como propranolol, metoprolol, etc. Se ha informado que el GABA causa una disminución de la PA de aproximadamente el 10%, pero el efecto fue transitorio, y la PA volvió a su valor inicial unos días después de suspender el GABA [74 ] .
La evidencia de al menos un estudio clínico muestra que la biodisponibilidad de GABA en el cerebro mejora significativamente cuando se toma simultáneamente con fosfatidilserina y, por lo tanto, GABA puede interactuar con medicamentos utilizados para tratar la epilepsia [115 ] . Se ha sugerido que la suplementación con GABA podría afectar el sistema nervioso entérico y posiblemente estimular la producción endógena de GABA en la BHE [ 116 , 117 ].
Se descubrió que la administración oral de una mezcla de GABA y L-teanina (100/20 mg/kg) a ratones ICR disminuye la latencia del sueño y prolonga la duración del sueño en comparación con el tratamiento con GABA o L-teanina solos después de una inyección intraperitoneal con pentobarbital sódico. Los autores concluyeron que el GABA y la L-teanina tenían un efecto sinérgico sobre el comportamiento del sueño de los ratones [ 118 ].
10. Seguridad del GABA como ingrediente dietético
En estudios clínicos, el GABA tomado por vía oral en dosis de hasta 120 mg/día durante 12 semanas no se asoció con efectos adversos [ 74 ]. En dosis mucho más altas de 5 g/día y 10 g/día, el único efecto secundario leve observado fue una ligera sensación de ardor en la garganta, que desapareció después de unos minutos [66 ] . Curiosamente, otro estudio también de Cavagnini et al. [ 66 , 67 ] que administraron 18 g/día de GABA puro no observaron ningún efecto adverso [ 67 ]. Otro estudio clínico que administró hasta 6 g al día (en dosis divididas de 2 g tres veces al día) durante 7 días no observó efectos adversos graves [ 101 ].
Las etiquetas de los productos que contienen GABA que se encuentran en el DSLD recomiendan cantidades de ingesta de hasta 3 g por día (rango de 45 mg a 3000 mg por día), aunque la mayoría de los productos (>70 % de los 38 muestreados) recomiendan entre 600 y 750 mg/día en dosis divididas. Las cantidades de ingesta recomendadas están muy por debajo de las cantidades de ingesta asociadas con efectos secundarios leves en Cavagnini et al. estudios [ 50 ] que administraron 5 go 10 g por día y 18 g por día durante 4 días sin observar efectos adversos graves [ 66 , 67 ].
11. Observaciones finales
Esta revisión se realizó como parte de una evaluación de admisión de suplementos dietéticos que se realiza para los ingredientes dietéticos antes de la admisión en el proceso de desarrollo de monografías de la USP. La intención de la revisión es determinar si un ingrediente está asociado con algún riesgo grave para la salud que impediría su admisión para el desarrollo de una monografía. Este informe es el resultado de una revisión de la información de seguridad clínica y preclínica disponible y no incluye una revisión de datos mecanísticos, ya que se consideró que estaba fuera del alcance de determinar si el GABA está asociado con un riesgo grave para la salud. Cuando corresponde y es necesario, hemos mencionado el mecanismo de acción del GABA. Por ejemplo, observamos que el efecto de capacitación de los espermatozoides GABA está mediado por un mecanismo mediado por el receptor GABA A.88 ]. También proporcionamos información de que parece haber un mecanismo de regulación interna in vivo que mantiene el equilibrio de los niveles plasmáticos de GABA independientemente de si se administra GABA externo [ 102] .]. La revisión no encontró estudios clínicos diseñados específicamente para estudiar la seguridad del GABA en individuos sanos. Tres estudios clínicos de corta duración (una dosis única de 5 g, 18 g durante 4 días y 5 g o 10 g diarios durante 5 días) administraron hasta 18 g de GABA, y en los tres estudios, sólo unos pocos Los participantes informaron una ligera sensación de ardor en la garganta inmediatamente después de tomar GABA, que cesó poco después. En algunos casos, la sensación de ardor iba acompañada de una breve dificultad para respirar. Además, la ingesta de 5 o 10 g al día durante 4 a 5 días provocó aumentos en la insulina inmunorreactiva y el glucagón, aunque no se observaron cambios en el nivel de glucosa en sangre [50 ] . En conjunto, no se asociaron efectos secundarios graves con la administración de GABA puro en dosis de hasta 18 g al día durante 4 días.
Datos clínicos de 16 estudios que examinaron el efecto del GABA en diferentes matrices (leche fermentada o soja) sobre la hipertensión leve, el insomnio y el estrés y como sustancia ergogénica en dosis que oscilan entre 10 mg y 12 mg/día durante hasta 12 semanas o 120 mg de GABA/día durante 12 semanas informaron que la ingestión de GABA no se asoció con ningún efecto adverso grave [ 50 , 61 , 62 , 63 , 64 , 66 , 67 , 74 , 119]. Algunos participantes experimentaron una caída moderada (cambio ≤10%) en la presión arterial, que volvió al nivel inicial unos días después de que los participantes dejaron de tomar el producto que contenía GABA. No se encontraron reportes de casos asociados con la ingesta de GABA. La revisión actual encontró un informe de evento adverso grave y espontáneo en la base de datos de CVP que involucró a un hombre de 23 años que había estado tomando 500 mg de GABA por vía oral durante 247 días. Debido a que el paciente estaba usando otros productos sospechosos, el papel del GABA, si lo hubiera, en los efectos adversos es incierto. FDA MedWatch arrojó 156 AER, de los cuales 151 (97%) estaban asociados con DS de múltiples ingredientes, y solo el 3% estaban asociados con productos de un solo ingrediente. Los efectos adversos informados en los REA de un solo ingrediente fueron todos diferentes y, por lo tanto, no se pudo determinar la causalidad debido a la limitada información disponible.
No se encontraron estudios de los efectos del GABA en el embarazo y la lactancia. Varios estudios in vitro de los efectos del GABA sobre la motilidad y la hiperactivación del esperma humano determinaron que el GABA estaba asociado con los parámetros cinemáticos del esperma y la hiperactivación, similar a los efectos de la progesterona en el esperma humano [87 ] . Debido a sus efectos sobre los neurotransmisores y el sistema endocrino (aumenta la hormona del crecimiento y la prolactina) y la ausencia de datos que respalden su uso durante el embarazo y la lactancia, puede ser aconsejable precaución en el uso de GABA durante el embarazo o la lactancia.
Los estudios de toxicidad aguda de GABA en ratas Sprague-Dawley a dosis de 1000 mg/kg de peso corporal determinaron una LD50 >1000 mg de GABA/kg de peso corporal [ 82 ]. Un estudio de 28 días y un estudio de 90 días en ratas determinaron un nivel sin efectos adversos observados (NOAEL) de 5 mg de GABA/kg de peso corporal por día, la dosis más alta probada [120 ] . En un estudio de 90 días, el volumen de orina aumentó significativamente en los hombres sólo con la concentración más alta analizada, 5 mg de GABA/kg de peso corporal. Sin embargo, esto no se asoció con otros efectos adversos sobre la función del tracto urinario y, por lo tanto, los autores consideraron que el efecto no era significativo. Se observó una disminución en los niveles de hemoglobina en algunas mujeres tratadas con GABA, pero esto no estuvo acompañado de anemia y no se observó en los hombres; por tanto, los autores concluyeron que este cambio no fue significativo.
A excepción de un estudio clínico que mostró una mayor biodisponibilidad de GABA en el cerebro cuando se toma simultáneamente con fosfatidilserina, no se identificaron otros estudios sobre la interacción de GABA con medicamentos o suplementos. Sin embargo, algunas investigaciones clínicas y en animales muestran que el GABA puede disminuir la presión arterial en sujetos hipertensos, por lo que es posible que el uso concomitante de GABA con medicamentos para la hipertensión pueda aumentar el riesgo de hipotensión.
Con base en esta revisión, el Comité de Admisión de Suplementos Dietéticos de la USP admitió GABA para el desarrollo de monografías de la USP. La monografía propuesta está en desarrollo y se prevé su publicación en el Foro de la Farmacopea de la USP en 2022.
Expresiones de gratitud
Los autores desean agradecer a los miembros del Subcomité Conjunto de Establecimiento de Estándares para la Evaluación de Admisión de Suplementos Dietéticos de la USP 2015-2020 por las valiosas discusiones de la revisión y a los siguientes colegas de la USP: Virginia (Kit) Goldman y Binu Koshy por revisar críticamente el manuscrito y a Christina G. .Persecución de la corrección del manuscrito.







