
Miquel Serra-Burriel1,2, Nicolau Martin-Bassols3, Gellért Perényi1 , Kerstin N. Vokinger1 1
Este trabajo resulta desafiante, original, y nos introduce a quienes no somos economistas de la salud, pero aprendemos de ellos, para gestionar mejor nuestros sistemas, hospitales y redes, tomar decisiones con la costo efectividad y la costo efectividad incremental como indicadores de peso en las opciones terapéuticas. Además conocer como se comportan los productores de medicamentos cuando lanzan un medicamento en la fijación del precio, que poco tiene que ver con el costo y finalmente si debemos hacer estudios dinámicos del costo efectividad, y de su variable incremental a lo largo del tiempo. Si para hacerlo se debe tomar el valor de lanzamiento o el actual, o de que país. También se impulsa construyendo dos escenarios dentro del análisis del mundo real. Quiero que lo lean, lo analicen, es para no perderse detalles, porque establece un desafío para todos nosotros mirando hacia el futuro. Fortaleciendo las herramientas que tenemos para valorar y sustentar nuestras decisiones. Espero que les produzca el mismo placer que tuve al leerlo. Esta dentro de la serie medicamentos genéricos que Ustedes generaron la semana anterior.

Este estudio analizó los efectos de la expiración de las patentes en los precios de los medicamentos en ocho países (EE. UU., Reino Unido, Canadá, Australia, Japón, Francia, Alemania y Suiza) y el impacto de esta dinámica de precios en las evaluaciones de costo-efectividad.
En primer lugar, utilizando un diseño de estudio de eventos, demostrando que los precios medios de los medicamentos disminuyeron sustancialmente ocho años después de la expiración de la patente.
A continuación, para evaluar las implicaciones de este hallazgo para las evaluaciones de costo-efectividad, un modelo teórico de costo-efectividad simuló dos escenarios del mundo real:
(1) el medicamento de comparación era genérico y la patente del nuevo medicamento expiró después de la entrada en el mercado;
(2) el medicamento de comparación también estaba protegido por patente, pero la patente expiró antes de la patente del nuevo medicamento. Si no se tenía en cuenta la genérica o la expiración de la patente del medicamento de comparación, se subestimó o sobreestimó la relación costo-efectividad incremental, respectivamente.
Nuestras estimaciones dinámicas de precios se pueden aplicar a los análisis de casos base de los modelos de rentabilidad
- Introducción
La pérdida de la protección de las patentes para los medicamentos originales y los productos biológicos (para simplificar, ambos se denominan «medicamentos») es un momento crucial para los fabricantes, los pacientes y la sociedad en general. Después de un período de internalización de beneficios por parte del innovador, la sociedad puede beneficiarse de la innovación a precios más bajos debido a la entrada en el mercado de versiones genéricas del medicamento original, lo que da lugar a una competencia de precios (Frank y Salkever, 1997).
Sin embargo, el nivel de competencia después de que los genéricos y los biosimilares (la clase de continuación de productos biológicos, para simplificar, ambos se denominan «genéricos») en el mercado varía considerablemente según los mercados y las naciones (Beall et al., 2020; Carl et al., 2022).
Las empresas de medicamentos originales tienen un incentivo para retrasar o impedir las competencias genéricas de sus productos para extender su monopolio temporal con diferentes estrategias que resultan en demandas antimonopolio (Böhme et al., 2021; Vokinger et al., 2017).
Los análisis de coste-efectividad (CEA) de nuevos medicamentos y productos biológicos suelen realizarse como base para las negociaciones de precios y las decisiones de reembolso, y para mejorar la eficiencia de los sistemas sanitarios (Clement et al., 2009). Los CEA se basan en análisis comparativos: los costes y la eficacia del nuevo fármaco original se comparan con los de un fármaco ya comercializado con la misma indicación.
Por lo tanto, el precio de las alternativas terapéuticas tiende a ser el factor que más contribuye a la hora de determinar los perfiles de costo-efectividad de los medicamentos. En general, los medicamentos originales están protegidos por patente en el momento de la entrada en el mercado y la expiración de la patente se produce algún tiempo después de la entrada en el mercado.
La mayoría de los CEA utilizan un precio fijo y no dinámico para las alternativas terapéuticas. En estudios previos, se ha criticado la suposición de que los precios se mantendrán constantes con el razonamiento de que esto no refleja adecuadamente el entorno del mundo real (Guertin et al., 2015), y ha habido debates sobre si la dinámica de precios de los medicamentos debe incorporarse a los CEA (Hirst et al., 2015; Schans et al., 2020). Algunos argumentaron que las estimaciones de la CEA se vuelven sesgadas al no incorporar la dinámica futura de los precios (Shih et al., 2016). Por el contrario, otros destacaron que las estimaciones del CEA dependen de la población objetivo y del momento de la inversión (Guertin et al., 2015).
A pesar de todas estas discusiones, existe, en cualquier caso, i) una falta de estimaciones de la dinámica de precios antes y después de la pérdida de la patente del nuevo medicamento original o medicamento comparativo, y ii) falta de claridad de su influencia en las estimaciones de costo-efectividad (Hoyle, 2008; Hua et al., 2019). Una revisión reciente evaluó hasta qué punto existe una orientación clara sobre esta cuestión, concluyendo que la omisión de supuestos sobre la genérica desorienta las evaluaciones de los costos de oportunidad a largo plazo, y destacando la necesidad de seguir trabajando en el área (Neumann et al., 2022).
Los dos escenarios más comunes en el mundo real para la CEA de nuevos medicamentos originales implican una comparación con un medicamento genérico u otro medicamento original bajo patente.
En el primer escenario, se espera que el precio del nuevo medicamento original disminuya sustancialmente después de la expiración de la patente, es decir, que mejore su perfil de costo-efectividad con el tiempo. Como resultado, es de suponer que se subestima su relación costo-efectividad incremental.
En el segundo escenario, se espera que la patente del medicamento de comparación expire antes que la patente del nuevo medicamento original. En este caso, ignorar la dinámica de los precios probablemente dará lugar a una sobreestimación de la rentabilidad del nuevo medicamento original al suponer que el precio del medicamento de comparación permanece constante y, por lo tanto, estimar un precio superior al real después de la expiración de la patente.
En este estudio, presentamos por primera vez una estimación integral de la dinámica de precios de genérica basada en un diseño de estudio de eventos. En primer lugar, comparamos los precios de los nuevos medicamentos originales antes y después de la pérdida de patentes con los medicamentos que no experimentaron la pérdida de patentes en el mismo período de tiempo en ocho de las principales economías desarrolladas. Luego, a través de estudios de simulación, evaluamos los efectos de incorporar dichas estimaciones en modelos de costo-efectividad en función de su perfil clínico y el tiempo hasta el vencimiento de la patente. En general, encontramos una fuerte disminución progresiva en los precios de los medicamentos después de la expiración de la patente que varió significativamente entre los países.
Finalmente, creamos un modelo teórico de costo-efectividad que simula dos escenarios comunes del mundo real: en el primer escenario, el nuevo medicamento original se comparó con un medicamento genérico, y la patente del nuevo medicamento original expira después de la entrada en el mercado. En el segundo caso, ambos fármacos, el nuevo fármaco original y el fármaco comparativo, estaban bajo patente en el momento inicial, pero el fármaco comparativo perdió la patente antes que el nuevo fármaco original. Para ambos escenarios, analizamos cómo la incorporación de la dinámica de precios afectó las estimaciones de costo-efectividad.
Nuestros resultados demuestran que en el primer escenario el perfil de coste-efectividad del nuevo fármaco original está ligeramente subestimado, mientras que en el segundo escenario el coste-efectividad del nuevo fármaco original está fuertemente sobreestimado
La estructura de este estudio es la siguiente: En la sección 2, se presentan tanto los métodos estadísticos y los datos para el análisis empírico como el modelo teórico de simulación de costo-efectividad. En la sección 3, describimos los resultados empíricos y de simulación, y discutimos los resultados en la sección 4.
- Métodos
Este estudio consta de dos partes diferenciadas: En primer lugar, un análisis empírico de la dinámica de los precios de los medicamentos, incluido el impacto de la competencia de precios en los precios de los medicamentos antes y después de la expiración de la patente, en ocho países (EE. UU., Reino Unido, Japón, Australia, Canadá, Francia, Alemania, Suiza). En segundo lugar, se construyó un modelo teórico de costo-efectividad para simular dos escenarios del mundo real con estimaciones de precios incorporadas.
2.1 Datos
Utilizamos datos de precios de medicamentos de IQVIA data (IMS health) para el período de 2011 a 2020 para ocho países: EE. UU., Reino Unido, Japón, Australia, Canadá, Francia, Alemania, Suiza. El conjunto de datos contiene información trimestral sobre los precios de lista, las unidades, las empresas, las moléculas, las dosis y el estado de las patentes de los medicamentos vendidos de forma privada. En el caso de los países incluidos, se disponía de datos sobre las ventas minoristas y hospitalarias. Nuestra unidad de observación fue a nivel de molécula y nuestro resultado fue el precio promedio ponderado por unidad para un trimestre determinado.
En el Cuadro S1 se presentan las estadísticas descriptivas de la muestra analítica por país incluido, y en el Cuadro S2 se muestra la disponibilidad de observaciones con respecto al momento de expiración de la patente junto con el estado de la patente. En nuestra muestra analítica, incluimos todos los medicamentos que estaban bajo protección de patente al inicio de la ventana de observación. Los medicamentos que perdieron su patente en cualquier momento entre 2011 y 2020 se clasificaron en el grupo de «tratamiento», y los medicamentos que no perdieron su patente en este período de tiempo se clasificaron en el grupo de «control». Nuestros datos contenían precios de lista ajustados por inflación nacional; no pudimos contabilizar los descuentos (Kakani et al., 2020).
2.2 Estrategia empírica
Para identificar los efectos de la expiración de las patentes en los precios de los medicamentos, aprovechamos el momento de la expiración de las patentes dentro de los países entre 2011 y 2020. Utilizamos la variación cuasi-experimental creada por la pérdida escalonada de patentes, que bajo un cierto conjunto de supuestos nos permitió aproximarnos al efecto causal de la expiración de las patentes en los precios de los medicamentos con una estrategia de diferencias en diferencias. Se estimó un modelo por país, de forma independiente. El principal supuesto de nuestra estrategia empírica era que, si los medicamentos no experimentaban la pérdida de patentes, sus precios habrían evolucionado en paralelo a los de las patentes. Bajo este supuesto, nuestro modelo descarta que los resultados estén impulsados por diferencias constantes de precios entre medicamentos y tendencias de precios nacionales comunes. Para proporcionar apoyo empírico a esta suposición, estimamos una versión dinámica para examinar la existencia de pretendencias con el estimador de diferencias-indiferencias de Callaway y Sant’Anna (Callaway y Sant’Anna, 2021). Otra razón para utilizar el estimador en lugar de un modelo estándar de efectos fijos de dos vías es que, si los efectos del tratamiento fueran heterogéneos a lo largo del tiempo, el estimador sería inconsistente. La estimación objetivo fue el efecto medio del tratamiento en el grupo tratado (ATT), es decir, el efecto de la pérdida de la patente de los medicamentos cuya patente expiró. Los errores estándar de los coeficientes de interés se agruparon a nivel de molécula. También realizamos el mismo modelo con un número de competidores que vendían la molécula en el mercado como resultado.
Por último, para proporcionar pruebas sugestivas sobre el efecto de la entrada de competidores en la competencia de precios, estimamos el efecto de un competidor adicional en el mercado sobre el precio de troza, utilizando un diseño de panel con efectos fijos por país, sustancia y tiempo:
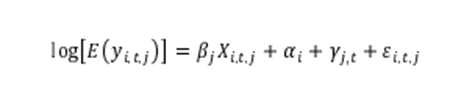
Donde, y(itj) es el precio ponderado unitario de la molécula i, en el cuarto calendario t, en el país j. El coeficiente de interés es Beta j, el efecto marginal de un competidor adicional sobre el logaritmo del precio, por país y período en un país determinado.
. representa los efectos fijos de la molécula, y los efectos fijos del cuarto de país. Finalmente, es un término de error idiosincrásico. También incluimos una especificación adicional con términos lineales y cuadráticos de número de competidores para proporcionar evidencia sugestiva sobre el efecto de la intensidad de la competencia en los precios.
Dónde, período en un país determinado. Estimamos el modelo con una especificación de quasi poisson, agrupamos los errores estándar a nivel de molécula por país y escalamos los coeficientes en dos desviaciones estándar (Gelman, 2008) para mejorar la comparabilidad entre países. Las estimaciones de este modelo deben interpretarse con cautela, ya que representan una aproximación mecanicista, y puede haber factores no capturados en la estructura de efectos fijos que afecten simultáneamente al precio y a la decisión de entrada de los competidores
- Modelización teórica de la relación coste-efectividad y estudios de simulación
Para evaluar la influencia de la dinámica de los precios después de la expiración de la patente en las estimaciones de costo-efectividad, creamos un modelo económico de salud simple. Compara dos tratamientos alternativos con la supervivencia de los pacientes como métrica de efectividad. Creamos dos escenarios que cubren la mayoría de los escenarios encontrados en las evaluaciones económicas de salud que tienen como objetivo servir de base para la negociación de precios y las decisiones de reembolso. En el primer caso, el medicamento original estaba sujeto a protección por patente durante un período de tiempo anterior a la expiración de la patente, mientras que el medicamento de comparación era un genérico. En el segundo caso, ambos medicamentos, el medicamento original y el medicamento de comparación, estaban protegidos por patente, y este último perdía la protección de la patente antes que el medicamento original. El modelo fue motivado por el hecho de que la mayoría de las evaluaciones económicas de los medicamentos se realizan cuando el nuevo medicamento original ingresa al mercado. En la mayoría de los casos, el nuevo fármaco está protegido por patente en el momento de su entrada en el mercado, pero perderá su patente en el plazo de modelización. El modelo incluye los costos incrementales y los efectos de supervivencia descontados a una tasa constante a lo largo del horizonte temporal:
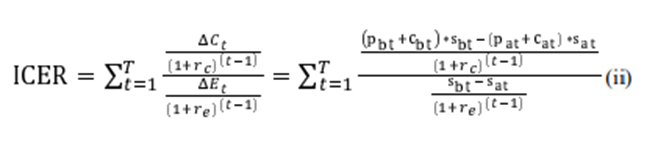
Cuando la eficacia incremental Δ se expresa como la diferencia en las tasas de supervivencia s s entre la intervención b y a, en el momento t. Los costos incrementales Δ se definen como la diferencia entre el precio del fármaco p más los costos no farmacológicos c multiplicado por la proporción de pacientes que sobrevivieron a S (suponiendo que los pacientes reciban tratamiento en vida) entre las intervenciones b y a. Tanto los costos incrementales como la supervivencia se descuentan en y respectivamente. Las derivaciones y los casos especiales del modelo se presentan en el material complementario. A continuación, incorporamos las estimaciones de precios de la evaluación empírica dos, ocho y 14 años después de los tiempos de introducción de la intervención objetivo. Se presentaron tres escenarios de efectividad con diferentes cocientes de riesgo de efectos sobre la supervivencia de (0,44, 0,58, 0,89), que representan una efectividad alta, media y baja. A continuación, evaluamos el alcance de la influencia que tiene la introducción de dinámicas de precios en función de los escenarios mencionados. 3. Results
3.1 Niveles de precios
En general, al comparar los ocho países incluidos en el estudio, Estados Unidos presentó los precios más altos de los medicamentos, tanto en términos promedio como en términos medianos. Los precios medios de lista en los Estados Unidos fueron entre 3,5 (Japón) y 1,6 (Alemania) veces más altos para los nuevos medicamentos originales protegidos por patente, y 4,1 (Australia) y 1,7 (Suiza) más altos para los medicamentos sin protección por patente. El patrón fue similar para los precios medios. En cuanto a la evolución de los precios a lo largo del tiempo, Estados Unidos experimentó el mayor aumento medio de los precios en el período de 10 años, con un crecimiento del 119%, mientras que para los demás países el aumento osciló entre el 10 y el 30%.
En el cuadro 1 se resumen las estadísticas de los precios
3.2 Estudio de eventos
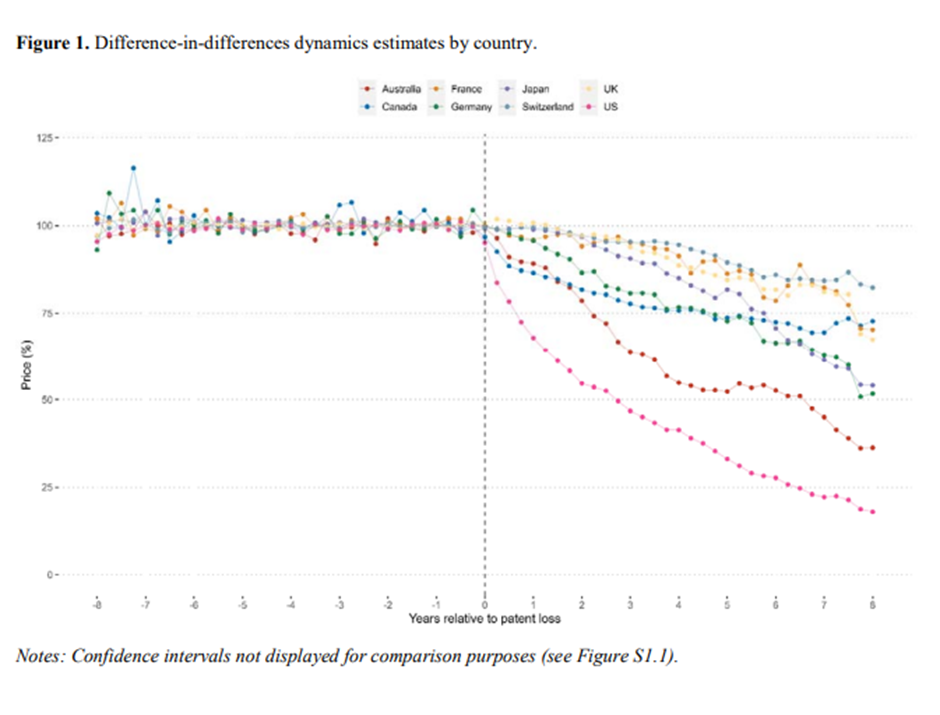
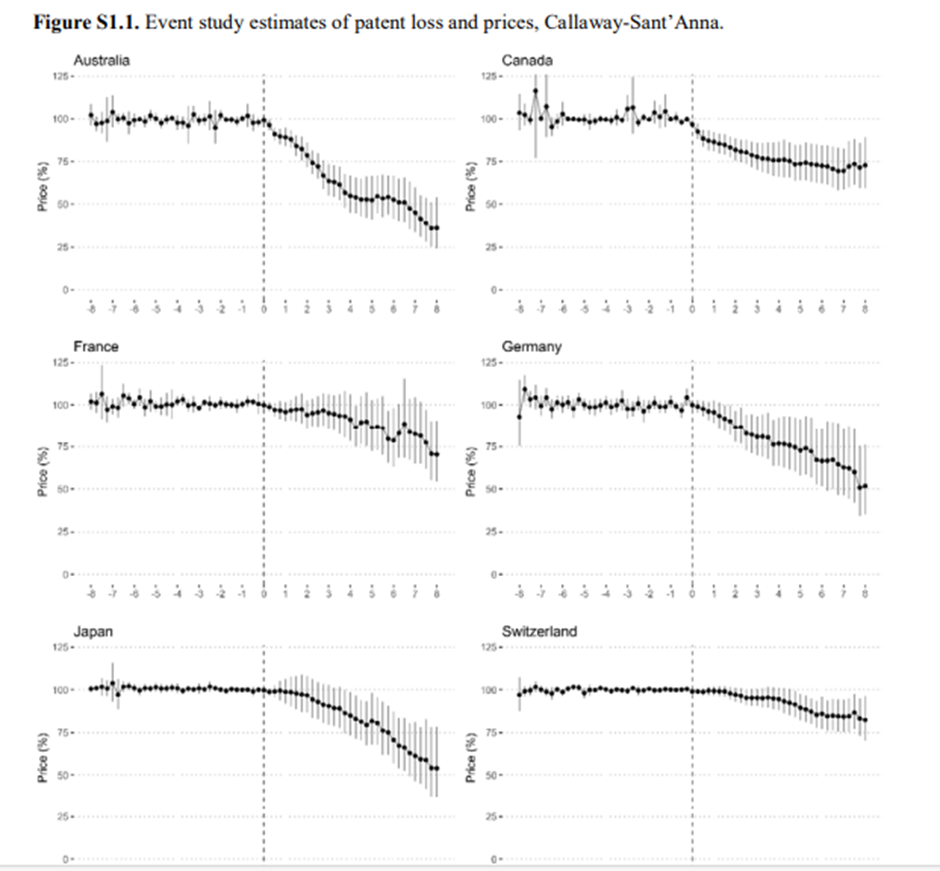
En la Figura 1 se presentan las estimaciones dinámicas del TCA a partir de nuestra especificación primaria por país, y se muestra que después de la expiración de la patente, los precios de los medicamentos disminuyeron en todos los países. Nuestras estimaciones previas a la intervención también respaldan en gran medida las tendencias paralelas en todos los países, hasta ocho años antes de la pérdida de patentes o 32 trimestres. Se observaron marcadas diferencias entre los países en cuanto al tamaño del efecto. Los Estados Unidos y Australia presentaron los descensos más pronunciados de los precios, alcanzando el 82% y el 64% ocho años después de la expiración de la patente en los Estados Unidos y Australia, respectivamente. Le siguieron Japón y Alemania, con un descenso de precios de aproximadamente el 50%. Canadá, Francia, Alemania y Suiza presentaron la menor disminución de precios con aproximadamente el 25%. En el Cuadro 2 se presentan las estimaciones numéricas y los intervalos de confianza para cada país, y en el
Gráfico S1.1. presenta todas las estimaciones de los países con sus respectivos intervalos de confianza.
3.3 Competencia
En general, el Tribunal constató que, tras la expiración de la patente, el aumento del número medio de competidores genéricos que entran en el mercado difiere considerablemente de un país a otro.
En la Figura S2 se presentan las estimaciones del estudio de eventos.
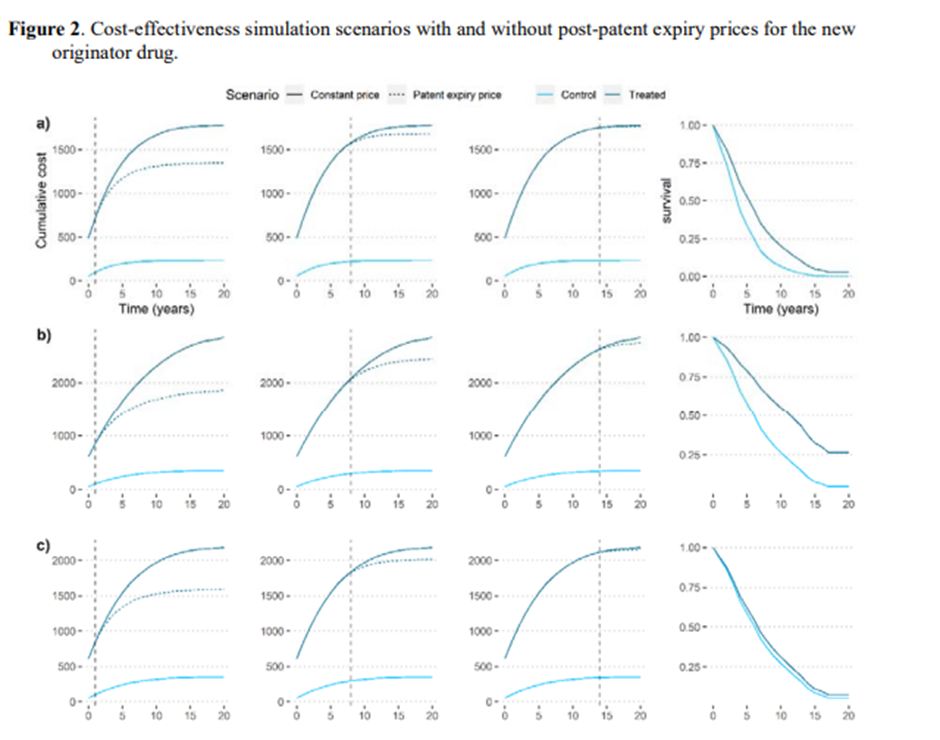
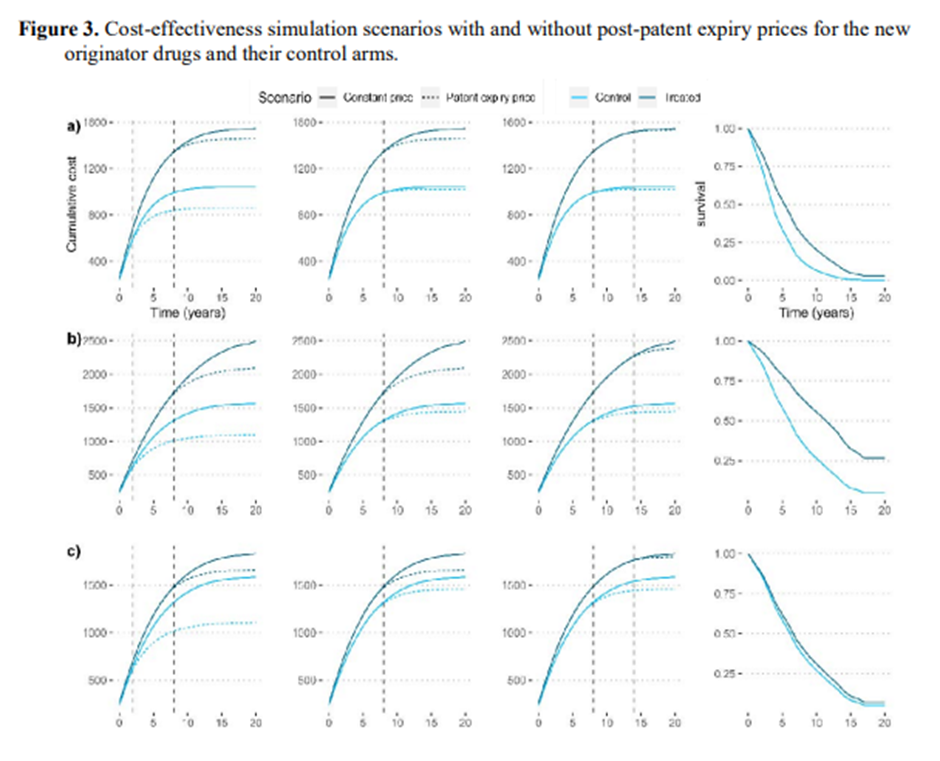
Notas: Los parámetros para la simulación fueron: Precio (anual) nuevo tratamiento $200,000, costos anuales sin tratamiento $50,000, precio del comparador $1,000. Los escenarios a), b) y c) presentan diferentes perfiles de supervivencia (efectividad). Escenario a): 0,58 HR, escenario b): 0,44 HR, escenario c) Escenario 0,89 HR. Las diferentes columnas presentan diferentes tiempos de vencimiento de la patente en relación con el momento de la evaluación de la inversión. La primera columna presenta un escenario en el que el medicamento patentado pierde la patente 2 años después de su introducción. La segunda columna presenta un escenario en el que la patente se pierde 8 años después y la tercera 14 años después. La última columna representa el perfil de supervivencia de cada grupo de tratamiento comparado. Para el escenario de efectividad a) asumir precios constantes vs dinámicos resulta en una subestimación en la RCIE del 33% para el primer caso, del 8% para el segundo caso y del 1% para el último caso. Para el escenario de efectividad b) asumiendo precios constantes vs dinámicos resulta en una subestimación en la RCIE del 45% para el primer caso, del 19% para el segundo caso y del 5% para el último caso. Para el escenario de efectividad c) asumir precios constantes frente a precios dinámicos da como resultado una subestimación de ov en la RCIE del 40% para el primer caso, del 12% para el segundo caso y del 2% para el último caso.
Encontramos el mayor número de competidores en Alemania, con aproximadamente 15 competidores que ingresaron al mercado hasta ocho años después de la expiración de la patente, seguidos de Japón (~ 10 competidores), Francia (~ 7 competidores) y los EE. UU. (~ 7 competidores). Por el contrario, Australia, Canadá, Suiza y el Reino Unido presentaron el menor número de competidores, con menos de 5 genéricos que entraron en el mercado después de la expiración de la patente.
La figura S3 presenta todas las estimaciones puntuales para facilitar la interpretación. Al examinar la influencia en el precio por competidor, encontramos el mayor tamaño del efecto para los EE. UU.,
Notas: Los parámetros para la simulación fueron: Precio (anual) nuevo tratamiento $200.000, costos anuales sin tratamiento $50.000, precio del comparador $180.000. Los escenarios a), b) y c) presentan diferentes perfiles de supervivencia (efectividad). Escenario a): 0,58 HR, escenario b): 0,44 HR, escenario c) Escenario 0,89 HR. Las diferentes columnas presentan diferentes tiempos de vencimiento de la patente en relación con el momento de la evaluación de la inversión. En la primera columna se presenta un escenario en el que el comparador perderá la protección de la patente 2 años después de la introducción de la nueva terapia, mientras que la nueva 8 años después de la introducción. La segunda columna presenta un escenario en el que ambos perderán la patente 8 años después del tiempo 0. La tercera columna presenta un escenario en el que el comparador perderá la patente 8 años después del tiempo 0 y el nuevo tratamiento 14 años después. La última columna representa el perfil de supervivencia de cada grupo de tratamiento comparado. Para el escenario de efectividad a) asumiendo precios constantes vs dinámicos resulta en una sobreestimación en la RCIE del 19% para el primer caso, una subestimación del 13% para el segundo caso y una sobreestimación del 1% para el último caso. Para el escenario de efectividad b) asumiendo precios constantes vs dinámicos resulta en una sobreestimación en la RCIE del 7% para el primer caso, una subestimación del 30% para el segundo caso y una sobreestimación del 2% para el último caso. Para el escenario de efectividad c) asumiendo precios constantes vs dinámicos resulta en una sobreestimación en la RCIE del 125% para el primer caso, una subestimación del 18% para el segundo caso y una sobreestimación del 39% para el último caso
Figura S4 (coeficientes estandarizados por dos desviaciones estándar). Las estimaciones sugieren que la competencia de precios variaba mucho y parecía ser independiente del número de competidores que entraron en el mercado.
En la figura S5 se presentan las estimaciones de los coeficientes lineales y cuadráticos de la cantidad de competencia. En general, las estimaciones de los términos lineales se mantuvieron estables.
3.3 Efectos de la relación coste-efectividad
Los principales resultados de nuestros modelos de simulación de coste-efectividad se presentan en la Figura 2 y la Figura 3. Todas las simulaciones incorporaron las estimaciones de precios de genérica de EE. UU. En el primer escenario, comparamos dos fármacos indicados para el mismo tratamiento. El primer medicamento fue un nuevo medicamento original con un precio anual de $200,000, el segundo medicamento fue un genérico de comparación con un precio anual de $1,000 y costos anuales no farmacéuticos de $50,000, en un horizonte de 20 años. El modelo solo incluyó la supervivencia global como resultado de la efectividad, diferenciando entre tres sub-escenarios: efectividad moderada, alta y baja. A continuación, analizamos las RCIE para diferentes escenarios, en los que la caducidad de la patente se producía dos, ocho y 14 años después de la evaluación. Nuestro modelo reveló que, si la expiración de la patente se produce 14 años después de la entrada en el mercado, ignorar la dinámica de los precios después de la expiración de la patente tiene un impacto muy pequeño en las RCEI, con una subestimación del 1%, 2% y 5%, para los casos de baja, media y alta efectividad. Por el contrario, si la expiración de la patente se produce un año después de la evaluación de la RCEI, la subestimación oscila entre el 33 y el 40 por ciento de la RCIE a precios constantes.
En el segundo escenario, comparamos dos fármacos indicados para el mismo tratamiento, ambos bajo protección de patente en el momento de la evaluación de la ICER.
El nuevo medicamento original tenía un precio anual de 200.000 dólares. El medicamento comparativo tuvo un precio anual de $180.000 y costos anuales no farmacéuticos de $50.000, con el mismo horizonte temporal, efectividad y tasas de descuento que en el primer escenario. Se analizaron tres sub-escenarios: En el primer sub-escenario, el fármaco comparador perdió su patente dos años después del tiempo cero y el nuevo fármaco original ocho años después. En el segundo sub-escenario, la patente de ambos medicamentos expiró ocho años después del tiempo cero. En el último sub-escenario, la patente del fármaco de comparación expiró ocho años después del tiempo cero, mientras que la patente del nuevo medicamento original expiró 14 años después del tiempo cero. Descubrimos que ignorar la dinámica de precios posterior a la patente tuvo un impacto significativo en la comercialización de los precios de los medicamentos de origen invernadero, con una sobreestimación de los precios de los precios de los productos de comparación, que oscilaba entre el 19 y el 125 % cuando la patente del comparador expiró antes de que se produjera el nuevo medicamento original.
Los resultados se pueden resumir de la siguiente manera: En primer lugar, si el nuevo fármaco original que se está evaluando tiene un perfil de eficacia elevado que da lugar a una administración prolongada de la terapia (es decir, un fármaco para una enfermedad crónica que se administra al paciente hasta la muerte o la progresión), ignorar la dinámica de precios posterior a la patente subestima la verdadera RCIE en los casos en que el medicamento de comparación es un fármaco genérico. En segundo lugar, si el medicamento de comparación todavía está protegido por patente en el momento de la evaluación, pero la patente expirará antes de la patente del nuevo medicamento original, ignorar la dinámica de los precios sobrestima gravemente su relación costo-efectividad. En tercer lugar, cuanto más cercano sea el tiempo transcurrido entre el CEA y el vencimiento de la patente, mayor será el sesgo de la verdadera RCEI. 4
El estudio tiene limitaciones.
En primer lugar, nuestro conjunto de datos contenía precios de lista para varios países. Muchos países han iniciado la incorporación de descuentos (confidenciales), de los que no hemos podido dar cuenta. Si estos descuentos aumentan después de la pérdida de la patente, nuestras estimaciones están sesgadas al alza. En segundo lugar, la comparabilidad de los precios entre países se ve comprometida debido a la diferencia en las fuentes de datos extraídas por los datos del IMS.
5. Conclusión
- Estimamos una disminución significativa en los precios de los medicamentos después de la expiración de la patente, que oscila entre el 30 y el 80%, dependiendo del país, ocho años después de la expiración de la patente.
- Nuestros resultados mostraron además que si el nuevo fármaco original en evaluación tiene un perfil de alta eficacia que da lugar a una administración prolongada de la terapia, ignorar la dinámica de precios posterior a la patente subestima la verdadera RCEI en los casos en que el fármaco de comparación es un fármaco genérico.
- Además, si el medicamento de comparación todavía está protegido por patente en el momento de la evaluación, pero la patente expirará antes de la patente del nuevo medicamento original, ignorar la dinámica de los precios sobrestima gravemente su relación costo-efectividad.
- Por último, cuanto más cerca esté la duración del tiempo entre el CEA y la expiración de la patente, mayor será el sesgo de la verdadera RCEI.
- Nuestras estimaciones dinámicas de precios se pueden aplicar a los análisis de casos base de los modelos de rentabilidad a lo largo del ciclo de vida de los medicamentos en EE. UU., Australia, Canadá, Francia, Alemania, Japón, Suiza y el Reino Unido





