Como parte de los cambios que la flamante administración está implementando en la FDA, en mayo se anunció una nueva medida que apunta a aumentar los esfuerzos por trasladar la fabricación de medicamentos a los Estados Unidos. El presidente Donald Trump firmó una orden ejecutiva para reducir el tiempo que lleva aprobar plantas farmacéuticas en el país por parte del organismo. Ver Trump promueve farma ‘Made in US’
Como parte de los cambios que la flamante administración está implementando en la FDA, en mayo se anunció una nueva medida que apunta a aumentar los esfuerzos por trasladar la fabricación de medicamentos a los Estados Unidos. El presidente Donald Trump firmó una orden ejecutiva para reducir el tiempo que lleva aprobar plantas farmacéuticas en el país por parte del organismo. Ver Trump promueve farma ‘Made in US’
La agencia también anunció que recurrirá a las inspecciones sorpresa fuera de los Estados Unidos. Según informaron, el objetivo es que las empresas extranjeras reciban «el mismo nivel de escrutinio» que las empresas nacionales. Asimismo, comenzó una puja para bajar los costos regulatorios para las empresas de farma. Esta iniciativa impone una política de desregulación de «10 a 1»: por cada nueva regulación propuesta, hay que revocar al menos diez existentes. Ver FDA: inspecciones sorpresa | Ver FDA busca eliminar regulaciones
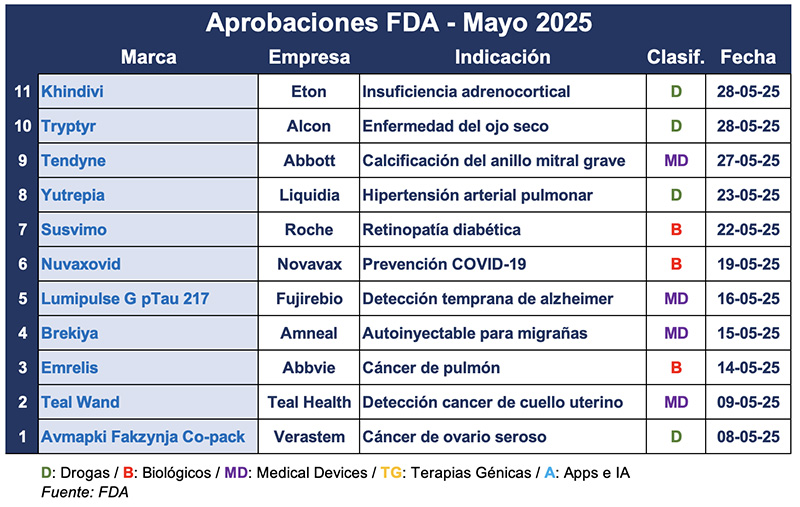
Y en el andarivel de las autorizaciones de mayo, llegó una para Alcon, el spin-off de la suiza Novartis especializada en el cuidado ocular. Fue para Tryptyr, a base de acoltremon, un nuevo tratamiento para la enfermedad del ojo seco. El producto líquido es un agonista del receptor TRPM8 que estimula los nervios sensoriales de la córnea para aumentar rápidamente la producción natural de lágrimas. Ver FDA: luz verde para Tryptyr de Alcon
También surgió un nuevo conjugado anticuerpo-fármaco de la norteamericana AbbVie, para adultos que ya recibieron tratamiento previo. A base de telisotuzumab vedotin-tllv, Emrelis está indicado para el cáncer de pulmón de células no pequeñas no escamoso con alta sobreexpresión de c-Met, una proteína conocida por desencadenar el desarrollo de tumores y la resistencia a ciertas terapias. Ver FDA: luz verde para Emrelis de AbbVie
En el quinto mes del año la FDA también autorizó una nueva indicación para Susvimo, el biológico de Genentech, la subsidiaria de la suiza Roche. El producto había recibido su primer visto bueno en 2021 para la degeneración macular neovascular relacionada con la edad. Ahora se agrega la prevención de la pérdida de visión por retinopatía diabética, requiriendo una aplicación cada nueve meses. Ver Press Release
Por otro lado le llegó el aval a Nuvaxovid, la vacuna COVID-19 de la norteamericana Novavax. Sin embargo, la misma solo recibió el visto bueno para su uso exclusivo en adultos mayores de 65 años, o en personas de 12 a 64 años que tengan al menos un problema de salud que los exponga a un mayor riesgo de contraer COVID-19. Esto a diferencia de vacunas como las de Pfizer y Moderna, que ya cuentan con aprobación completa. Ver FDA: restricciones para vacuna COVID de Novavax
Y a principios de mes la FDA le otorgó la aprobación acelerada a la combinación de avutometinib y defactinib de Verastem, la empresa ubicada en Massachusetts. Bautizado Avmapki Fakzynja Co-pack, el combo está indicado en pacientes adultos con cáncer de ovario seroso de bajo grado recurrente con mutación KRAS que hayan recibido terapia sistémica previa. Ver Press Release
Asimismo, la FDA le dio el OK a Teal Health de San Francisco para el primer test hogareño para la detección del cáncer de cuello uterino. El Teal Wand ofrece una alternativa a las pruebas de Papanicolaou como el Cobas HPV de la suiza Roche que deben realizarse en un consultorio médico. Ver FDA: Test hogareño cáncer cervical
También en mayo, la japonesa Fujirebio anunció que la FDA le dio el OK a la comercialización de su sistema para la detección temprana del alzheimer a través de pruebas de sangre. Denominada Lumipulse G pTau 217/β-Amyloid 1-42 Plasma Ratio, esta es una prueba dirigida a adultos mayores de 50 años que empiezan a mostrar signos de deterioro mental. El test puede realizarse utilizando el sistema Lumipulse G1200, que el organismo tiene aprobado desde 2022. Ver Press Release
Otro dispositivo aprobado este mes fue el del laboratorio de New Jersey, Amneal Pharmaceuticals. Sse trata del primer producto autoinyectable para tratar migrañas. Brekiya administra una dosis única de mesilato de dihidroergotamina mediante un autoinyector. Está aprobado para el tratamiento de casos agudos de migraña y dolor de cabeza intenso y unilateral, conocido como cefalea en racimos, en adultos. Ver FDA avala autoinyector para migrañas
La estadounidense Abbott obtuvo la aprobación de la FDA para su sistema de reemplazo valvular mitral transcatéter (TMVR) Tendyne. El producto está diseñado para ayudar a pacientes con calcificación del anillo mitral grave, que afecta el correcto funcionamiento de la válvula mitral. Ver FDA: aval para Tendyne
Además, la norteamericana Liquidia recibió el visto bueno para dos indicaciones de su producto Yutrepia. A base de treprostinil, es un análogo de prostaciclina, que ahora está indicado para uso en personas con hipertensión arterial pulmonar, o con hipertensión pulmonar asociada con enfermedad pulmonar intersticial. El mismo se administra a través de un polvo inhalable diseñado por su tecnología PRINT, la que genera uniformidad en las particulas para ayudar en su absorción. Ver Press Release
La también estadounidense Eton anunció a fines de mayo que su producto Khindivi consiguió luz verde por parte de la FDA. Indicada para mayores de cinco años con insuficiencia adrenocortical, esta es la primera vez que la hidrocortisona cuenta con una presentación de solución oral, constituyéndose en una terapia de reemplazo de las formas en comprimidos. Ver Press Release
Origen: Las aprobaciones FDA de mayo – Pharmabiz.NET