Las autorizaciones emitidas por la FDA funcionan históricamente como guía para sus pares globales, que suelen basarse en ellas al momento de decidir sobre la aprobación de nuevos productos. En este marco, adquiere especial importancia repasar las resoluciones adoptadas por la agencia, y esta semana publicó su tradicional informe anual sobre sus nuevos avales.
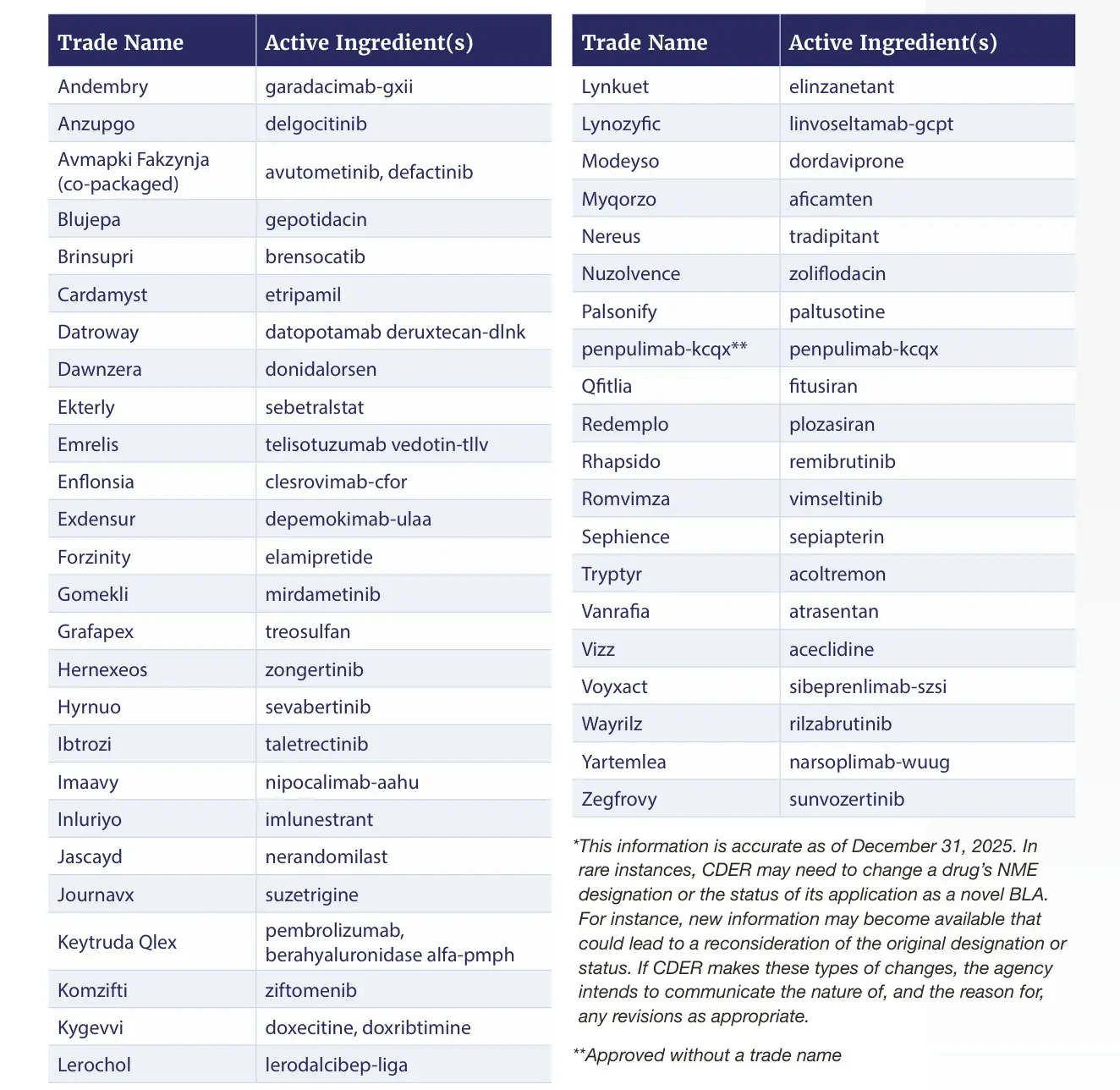
En el mismo detalla que su Centro de Evaluación e Investigación de Medicamentos, el CDER, aprobó 46 nuevas moléculas en 2025. Esta cifra se compara con 50 en 2024 y 55 en 2023. La mitad se centraron en enfermedades raras, y el 43% fueron primeras en su clase. Ver Informe
Las mismas fueron Andembry de CSL; Avmapki Fakzynja de Verastem Oncology; Blujepa de GSK; Brinsupri de Insmed; Dawnzera de Ionis; Emrelis de AbbVie; Forzinity de Stealth BioTherapeutics; Jascayd de Boehringer Ingelheim; Journavx de Vertex Pharmaceuticals; Kygevvi de UCB; Lynkuet de Bayer; y Modeyso de Jazz Pharmaceuticals.
También Nuzolvence de Innoviva Specialty Therapeutics; Qfitlia de Sanofi; Redemplo de Arrowhead Pharmaceuticals; Rhapsido de Novartis; Tryptyr de Alcon; Voyxact de Otsuka; Wayrilz de Sanofi; y Yartemlea de Omeros.
La FDA destacó la aprobación de Journavx, el nuevo analgésico no opioide, como parte de sus esfuerzos para combatir la epidemia de opioides en EE.UU. En tanto, resaltó Blujepa, que en marzo se convirtió en la primera nueva clase de antibióticos orales para infecciones del tracto urinario no complicadas, ITU, en casi 30 años. El mismo producto fue avalado para el tratamiento del gonorrea urogenital no complicada en diciembre, seguido un día después por Nuzolvence.
Del total, 33 de las aprobaciones de medicamentos novedosos utilizaron uno o más de los programas acelerados de la FDA, como la aprobación acelerada, la designación de terapia innovadora, la designación de vía rápida y la revisión prioritaria. La directora interina del CDER, Tracy Beth Høeg, puso énfasis en que la mayoría de los nuevos tratamientos fueron aprobados antes de sus fechas límite y que para muchos el OK de la FDA fue su primer aval global.
Por otro lado, la FDA pasó lista de las expansiones de productos ya aprobados. Acá hizo hincapié en la expansión de la etiqueta de Wegovy de Novo Nordisk para incluir el tratamiento de la esteatohepatitis asociada a disfunción metabólica, MASH.
Asimismo, el informe resalta la primera acción de la FDA a través del nuevo programa de National Priority Vouchers, CNPV. Augmentin XR de USAntibiotics fue re-aprobado en diciembre para el tratamiento de la neumonía adquirida en la comunidad y la sinusitis bacteriana aguda. Un review de apenas dos meses facilitó el relanzamiento del antibiótico combinado de liberación prolongada con el objetivo de fortalecer la cadena de suministro de medicamentos en EE.UU.
Nota: en Pharmabiz no nos apoyamos en la inteligencia artificial para el armado de los artículos. Nuestro equipo de periodistas profesionales coteja y redacta cada dato.
Origen: FDA: informe de las aprobaciones 2025 – Pharmabiz.NET