En el momento en que escuchó que su madre, entonces de 67 años, tenía cáncer de mama avanzado, Stacie Dusetzina comenzó a buscar posibles tratamientos. Investigador de la política de cáncer en la Universidad de Vanderbilt, Dusetzina sabía que el fármaco de referencia en muchos casos era Pfizer Ibrance. Aprendió que le podría costar a su madre, que vivía con un ingreso fijo, alrededor de US$10.000 de su bolsillo anualmente.
Medicare, requerido por la ley para cubrir el tratamiento del cáncer, habría pagado gran parte del resto del costo. En ese momento, en 2020, la píldora listada para un asombroso US$160.000 al año, aumentando más recientemente a US$214.000.
A pesar de tener un doctorado en ciencias farmacéuticas, Dusetzina no pudo averiguar si tragar esos costos potencialmente durante años ayudaría a su mamá ya fuera o mejor. Su investigación mostró que si bien el fármaco podría encoger tumores, ningún ensayo clínico demostró que extendería la vida de su madre. En el momento de su búsqueda, Ibrance ya llevaba cinco años en el mercado. No pude encontrar ningún dato satisfactorio donde pudiera decir que vale la pena el dinero, dijo Dusetzina, cuya madre terminó no consumiendo el fármaco porque tenía un tipo de cáncer menos común. Fue realmente frustrante.
Ibrance es uno de los medicamentos más vendidos en una revolución que ha puesto nuevos tratamientos a disposición de los pacientes estadounidenses de cáncer más rápido que nunca. Impulsado por una legislación respaldada por los fabricantes de medicamentos que permitió a la Administración de Alimentos y Medicamentos acelerar las aprobaciones, el regulador ha limpiado más de 200 medicamentos contra el cáncer en las últimas tres décadas. Los tratamientos contra el cáncer generaron al menos US$200.000 millones en ventas mundiales para la industria farmacéutica el año pasado, convirtiendo el negocio de oncología antaño dormido en una mina de oro más de 10 veces mayor que los medicamentos contra la obesidad.

La profusión de nuevos tratamientos es una fuente de esperanza para muchos pacientes. Algunos medicamentos cambian el juego, especialmente nuevas terapias inmunes que enseñan al propio cuerpo cómo destruir las células cancerosas. Pero la desventaja de aprobar tantas drogas con tan pocos obstáculos ahora está clara: Muchos no prolongan la vida en absoluto, o lo hacen sólo modestamente, con efectos secundarios problemáticos. De hecho, menos de la mitad de los medicamentos contra el cáncer aprobaron desde 2000 que Bloomberg News revisó en base a sus etiquetas de la FDA se ha demostrado alguna vez que extienden la supervivencia de los pacientes para cualquiera de sus usos aprobados. Incluso se ha demostrado que un menor mejoramiento de los síntomas relacionados con el cáncer o la calidad de vida.
Sólo en la última década, los fabricantes de medicamentos han ganado más de US$50.000 millones en medicamentos contra el cáncer que hasta ahora no han demostrado ningún beneficio de supervivencia, según el análisis de Bloomberg.
Hay un mito de que estos medicamentos contra el cáncer están salvando enormes cantidades de vidas, dice Richard Sullivan, profesor de cáncer y salud global en el Kings College de Londres. No es verdad.
Todavía se están llevando a cabo los juicios que, según las compañías, podrían probar algún día que sus drogas alarguen vidas. Algunos tratamientos para cánceres raros han mantenido a los pacientes en remisión durante años, incluso cuando no tienen datos formales de ensayos de supervivencia controlada. Los verdaderos éxitos han ayudado a muchos miles de pacientes con cáncer a vivir más tiempo. La Sociedad Estadounidense del Cáncer dice que las tasas de mortalidad por cáncer de Estados Unidos se han desplomado 34% desde que alcanzó su máximo en 1991, gracias a la detección temprana, los avances en los medicamentos y la disminución del tabaquismo. Las inmunoteras revolucionaron el tratamiento del melanoma, al tiempo que extendían la supervivencia más modestamente en los cánceres de pulmón y otros órganos. Los fármacos que bloquean proteínas hiperactivas específicas han mejorado las perspectivas de ciertos tipos de cáncer de mama, leucemia y mieloma.
Sin embargo, un análisis de JAMA Oncology de un subconjunto de tumores sólidos importantes estimó que cuatro de cada cinco muertes por cáncer evitadas entre 1975 y 2020 se debieron a mejores exámenes de detección y medidas preventivas de salud, no a nuevos tratamientos. Las tasas de supervivencia siguen siendo relativamente bajas para algunos tipos de cáncer avanzado, incluyendo el cáncer de colon avanzado, el segundo mayor asesino – y los cánceres de páncreas y ovarios.
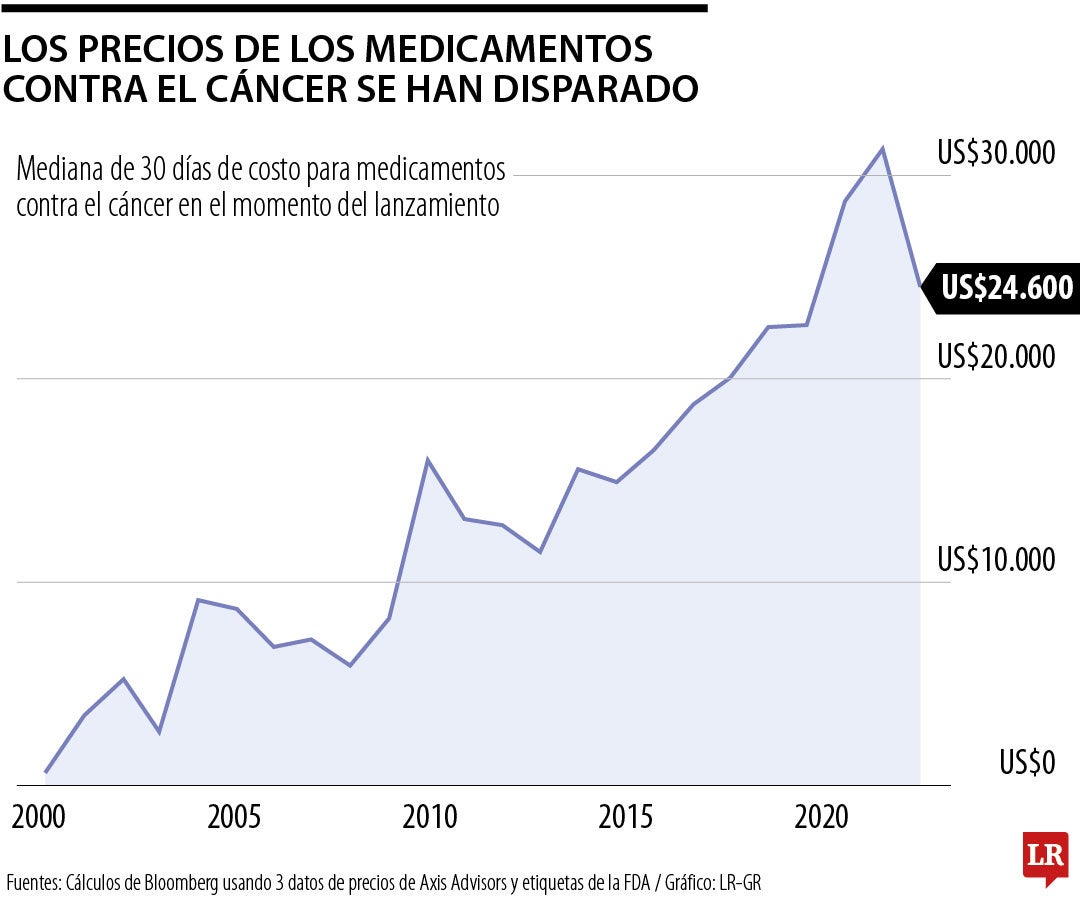
El cáncer avanzado generalmente no se puede curar, y los nuevos medicamentos han cambiado eso. Todavía se utilizan a menudo en combinación con quimioterapia tóxica y radiación, a un costo asombroso: el análisis de Bloomberg encontró que el precio inicial medio de un nuevo medicamento contra el cáncer se ha cuadruplicado después de la inflación desde principios de la década de 2000 a unos US$25.000 al mes en los últimos años. Mientras tanto, un próximo estudio del investigador de la Universidad de Columbia Tito Fojo midió cuánto tiempo mejora el nuevo fármaco medio que trata la enfermedad: unos tres meses.
Sullivan dice que sus pacientes asumen que cada medicamento recién licenciado es fantástico y cuando les dices que no es el caso, se molestan súper.
El aumento de lo que algunos médicos ahora llaman el complejo industrial de cáncer es en parte una historia familiar de un regulador capturado que extrae gran parte de su financiación de la industria que se supone que monitorea. A cambio de que las compañías farmacéuticas y los fabricantes de dispositivos médicos paguen honorarios que ahora traen casi la mitad del presupuesto anual de US$7.000 millones de la FDA, el Congreso efectivamente les ha dado formas cada vez más de acortar las pruebas y recibir tratamiento prioritario de los revisores de la agencia.
Este nuevo capitalismo contra el cáncer, sin embargo, también es una historia poco conocida de juegos científicos. Un imperio de drogas surgió de la capacidad de las empresas para explotar un marcador específico: una medida del crecimiento tumoral conocida como “viven libre de progresión”. Un término oscuro utilizado principalmente por los médicos hasta que una definición estandarizada apareció en una revista académica en 2000, desde entonces se convirtió en una justificación común para la aprobación acelerada de tratamientos de la FDA. Los investigadores asumieron que si un fármaco retrasaba el crecimiento de los tumores, también alargaría la vida. Estudios recientes han encontrado que el vínculo no es tan claro, e incluso uno de los creadores de la medida lo llama arbitrario.
Sin embargo, demostrar una mejora de 10 meses en esta métrica convirtió a Pfizer Ibrance en un éxito de taquilla. Una cosa nunca se ha demostrado que haga: prolongar la vida de las mujeres. Ibrance fue el fármaco más vendido en la encuesta de Bloomberg que se quedó corto en esta medida, considerado durante mucho tiempo el patrón oro de los ensayos clínicos. En particular, un estudio de 2022 no mostró una mejoría estadísticamente significativa en la supervivencia de más de 600 mujeres que inicialmente fueron diagnosticadas con cáncer de mama avanzado, el uso principal del fármaco. Las mujeres tendrían que leer profundamente en la letra fina en la página 19 de la etiqueta para averiguarlo.
Es increíblemente confuso para los pacientes y sus familias saber a qué se están inscribiendo, dice Vanderbilt’s Dusetzina.
Las compañías farmacéuticas mejoraron el oleojo de nuevos tratamientos trabajando con grupos de defensa de los pacientes, liderados por voceros simpáticos: enfermos de cáncer. Las compañías ayudan a financiar los presupuestos de los grupos, patrocinar sus conferencias y a veces pagar a los miembros para que consulten sobre los estudios. Los hospitales, por su parte, comparten los márgenes de administración de los medicamentos y también se les paga por llevar a los pacientes a los ensayos.
La creciente dependencia de la industria en las últimas décadas ha tenido otros efectos duraderos. Antes de patrocinar y pagar principalmente por el gobierno, los ensayos de medicamentos contra el cáncer ahora son concebidos, organizados y pagados en gran medida por las empresas. Eso significa que las preguntas básicas a veces no tienen respuesta: Cuando debe interrumpirse el tratamiento, cuánto tiempo debe durar el tratamiento y cuándo no es necesario en absoluto? Estudios emergentes sugieren que en algunos casos las dosis recomendadas pueden ser más altas de lo requerido, y administradas durante más tiempo del necesario, un resultado potencialmente lucrativo para los fabricantes de medicamentos que son pagados por dosis.
Más que ninguna parte de la FDA, la división del cáncer ha adoptado el concepto de permitir que los medicamentos sean aprobados con base en datos preliminares. Llevó en ese esfuerzo a su antiguo jefe de oncología, Richard Pazdur, quien ha atribuido su propia conversión de “regulador” a “regulador-abogado” en parte a la muerte de su esposa por cáncer de ovario.
Movirse más rápido es popular entre muchos grupos de pacientes. También dio lugar a productos con beneficios inciertos que permanecían en el mercado durante años, ensillando a algunos pacientes con tratamientos innecesarios o, en algunos casos, efectos secundarios potencialmente mortales. Nunca miran la vida en esos días, dice Rachel Koven, cuyo marido murió de cáncer de unión gastroesofágica en 2016. Ella dice que pasó gran parte de sus últimos cuatro meses en el hospital siendo tratado por efectos secundarios de varios tratamientos que no funcionaron, manteniéndolo lejos de casa durante los preciosos últimos meses de su vida. Hasta el día de hoy, ella no está segura de que todos los tratamientos adicionales valieran la pena.
El nuevo secretario de Salud y Servicios Sociales, Robert F. Kennedy Jr., y Marty Makary, el recién nombrado comisionado de la FDA, son ellos mismos críticos entusiastas de las agencias que ahora dirigen. Kennedy ha llamado a la agencia un títere para la industria y Makary es un cirujano prominente que escribió libros sobre los absurdos de la economía médica de los EE.UU., incluyendo The Price We Pay: What Broke American Health Care y How to Fix It.
El presidente Trump, por supuesto, se ha echado durante mucho tiempo como un flagelo de la industria; una orden ejecutiva que emitió este mes busca forzar recortes de hasta el 80% en los precios de los medicamentos. Pero un esfuerzo similar en su primera administración murió en los tribunales. Y las acciones farmacéuticas subieron el día de su nuevo orden, lo que indica el escepticismo de los inversores sobre cualquier impacto significativo de ella.
Mucho más tiempo que Trump ha comandado la etapa política nacional, el funcionario de la FDA que guía la revolución de los medicamentos contra el cáncer ha sido Pazdur, un ex oncólogo gastrointestinal del MD Anderson Cancer Center en Houston. Dirigió la división de oncología de la FDA desde 1999 y es uno de los pocos altos funcionarios de la agencia que ha permanecido en su puesto bajo la nueva administración. En una breve entrevista después de recibir un premio a la esperanza de vida en una conferencia sobre el cáncer en Chicago el mes pasado, Pazdur se llamó en broma a sí mismo “el sobreviviente designado” y dijo que no sabe si la nueva administración buscará cambios en los estándares de aprobación.
Un portavoz de la FDA dice que el desarrollo de las drogas, especialmente en oncología, no es estático y que el programa de aprobación acelerada “intenta el equilibrio entre la necesidad de evaluaciones generales de supervivencia y la necesidad de que los pacientes tengan acceso oportuno a nuevos medicamentos”.
La tenencia de Pazdurs se remonta a un momento en que la FDA, picada por las críticas públicas a su respuesta a la crisis del VIH, enfrentó una creciente presión para conseguir medicamentos en el mercado más rápido. Un editorial del Wall Street Journal de 2002 pintó a la agencia como un desastre burocrático que retrasó tratamientos prometedores de todo tipo, incluso para el cáncer. Se tituló: “FDA” a los pacientes: Drop Dead.
Bajo Pazdur, la división de oncología hizo un uso más frecuente de un programa de aprobación acelerada que se basa en medidas clínicas a corto plazo, como el tamaño del tumor, para evaluar posibles tratamientos. El cambio fue bien recibido por los pacientes y especialmente por la industria, que era cada vez más responsable, como dijo un ex comisionado de la FDA, tratando de mantener las luces encendidas en la agencia.
En 1992, el Congreso había aprobado un programa de honorarios de usuario bajo el cual las compañías farmacéuticas financiaron una parte del presupuesto de la FDA. A cambio, la agencia acordó acelerar las revisiones de algunas drogas que consideraba aplicaciones prioritarias a tan solo seis meses. Una ley de 1997 había aliviado aún más las normas de aprobación, permitiendo a la agencia acelerar ciertas drogas sin su requisito tradicional de dos ensayos bien controlados.
En ese momento, los avances en genética estaban abriendo oportunidades emocionantes. Los investigadores comenzaron a identificar genes mutados que impulsaron el crecimiento del cáncer. Le dio a las compañías farmacéuticas objetivos moleculares específicos por primera vez. Sintiendo un nuevo mercado atractivo, las empresas se centraron en formas de llevar sus medicamentos al mercado más rápido que los estudios de supervivencia de años.
Pronto encontraron uno. En 2000, un grupo internacional de académicos diseñó nuevas normas para medir el crecimiento de los tumores. Una vez que crecieron 20% en sus dimensiones más largas, o apareció cualquier nuevo tumor, se consideró que la enfermedad había “progresado”.
El umbral fue elegido porque era la cantidad más pequeña que podía indicar que un tratamiento ya no funcionaba, dice Elizabeth Eisenhauer, una profesora emérita de la Universidad Queen en Ontario que ayudó a idear los estándares. La idea era evaluar si un agente era prometedor o no, permitiendo a los médicos pasar rápidamente a los ensayos que evalúan la supervivencia, dice. Fue arbitrario, dice Eisenhauer, quien advierte contra la lectura demasiado en la medida. Un fármaco podría reducir los tumores, sólo para tener efectos secundarios tóxicos que aceleren la muerte.
Aún así, una vez que los nuevos estándares fueron publicados en el Journal of the National Cancer Institute ese año, las compañías farmacéuticas se apoderaron de ellos. La supervivencia sin progresión fue más fácil de demostrar que la supervivencia real; sólo tuvieron que mantener el crecimiento del tumor por debajo de ese umbral mágico de 20% durante tan sólo un período de escaneo, típicamente de seis a ocho semanas. A mediados de la década de 2000, la FDA comenzó a aprobar medicamentos contra el cáncer basados en su capacidad para ralentizar el crecimiento tumoral, con la idea de que la métrica predeciría de manera fiable qué fármacos prolongaban las vidas de los pacientes.
A veces lo hacía. A menudo, no lo hizo. Una revisión en el European Journal of Cancer encontró que dos tercios de los ensayos de medicamentos con el objetivo de frenar la progresión de los tumores sólidos se consideraron exitosos de 1999 a 2015. Esto resultó ser un predictor sorprendentemente pobre de si los pacientes viven más tiempo – lo que ocurrió en sólo 38% de esos casos.
Los fabricantes recibieron una vía rápida adicional con la aprobación del Congreso de otra categoría conocida como medicamentos de la terapia de vanguardia. El concepto provenía de Amigos de Cancer Research, un grupo fundado por Ellen Sigal, una promotora inmobiliaria con un doctorado de literatura rusa cuya hermana había muerto de cáncer. Ella fue co-autora de una columna para The Hill con un ex comisionado de la FDA en abril de 2012, pidiendo la designación de “breakthrough” para los agentes que parecía prometedora al principio de las pruebas.
El esfuerzo llegó en un momento de entusiasmo particularmente alto por los medicamentos contra el cáncer, después de que múltiples medicamentos habían reforzado la supervivencia en melanoma avanzado, considerado anteriormente uno de los más difíciles de tratar.
El grupo de Sigalés organiza mesas redondas regulares que reúnen a empresas y reguladores; Pazdur es un altavoz frecuente en sus eventos. Cerca de 64% de sus US$6,8 millones en financiamiento el año pasado provenían de compañías farmacéuticas y biotecnológicas como Pfizer, Sanofi y Amgen Inc., según Friends. Los desafíos que pretendemos abordar surgen y evolucionan debido al rápido ritmo del progreso científico, dice un portavoz. Esa es la fuente de nuestra agenda y los proyectos que asumimos, no las directivas de la industria ni de ninguna de las partes. No importa el tema nos esforzamos hacia soluciones basadas en evidencias.
La ley que el Congreso aprobó en 2012 requería que la FDA considerara las solicitudes para la nueva designación de Abreakthrough en un plazo de 60 días y trabajara con el patrocinador en un diseño de prueba que sería tan eficiente como sea posible… como minimizar el número de pacientes. La ley también avaló el concepto de utilizar los datos clínicos a corto plazo como base para las aprobaciones aceleradas. En la década hasta 2020, el 85% de los medicamentos concedidos a la aprobación acelerada de cáncer tratado, muchos de ellos se basaron en la prevención del crecimiento tumoral.
Se convirtió en un atajo a un éxito financiero, no médico, de taquilla que recompensa a los inversores más rápido, dice Christopher Booth, un oncólogo de la Universidad de Queens en Ontario. El listón es más bajo, dice. Sólo tienes que demostrar que puedes retrasar el crecimiento del tumor literalmente ocho semanas sin tener al paciente más tiempo o sentirte mejor. Y esa es una droga multimillonaria justo ahí.
En el primer año completo del programa, la FDA obtuvo más de 90 solicitudes para la nueva designación de avance. Entre ellos había una droga de Pfizer llamada palbociclib.
Investigadores de la Universidad de California en Los Ángeles habían estado investigando un complejo de Pfizer, PD-0332991, en el laboratorio desde mediados de la década de 2000. Ahora más conocido por su nombre de marca, Ibrance, palbociclib parecía dirigirse a proteínas específicas, CDK4 y CDK6, que pueden volverse hiperactivas y conducir al desarrollo del tipo más común de cáncer de mama avanzado. Después de un ensayo clínico en UCLA en 12 mujeres, cuatro tuvieron respuestas significativas.
Los investigadores se embarcaron en un ensayo Fase 2 del fármaco que finalmente incluyó 165 pacientes. La FDA otorgó un estatus de avance en abril de 2013 después de que los resultados iniciales demostraran que retrasó significativamente el crecimiento de tumores en combinación con un tratamiento hormonal estándar.
Siguieron las revisiones con un equipo de la agencia, como manda la nueva ley. Algunos funcionarios señalaron que el estudio fundamental fue pequeño, según reunión minutos después hecho público. Señalaron que era difícil sacar conclusiones porque una parte del ensayo estudiaba sólo a las mujeres con ciertas alteraciones genéticas. Pfizer esperaba obtener la aprobación para usar el medicamento más ampliamente.
Ese mayo, un equipo de la FDA se reunió con ejecutivos de Pfizer en una sala de conferencias en Silver Spring, Maryland. Un revisor de la agencia calificó los resultados iniciales de animación y dijo que esperaba ver datos más completos de la Fase 3, recuerda Mace Rothenberg, entonces jefe de desarrollo de la unidad oncológica de Pfizer. Eso podría añadir años. Entonces, recuerda, la voz de Pazdur se encendió desde un altavoz en el techo: “No estoy tan seguro de estar de acuerdo con eso”.
El jefe de oncología no había hablado hasta ese momento, pero argumentó que los desafíos del juicio podían superarse. Sabíamos que teníamos algo de tracción, recuerda Rothenberg.
La esposa de Pazdurs, Mary, que trabajaba en el MD Anderson como enfermera de oncología, estaba en ese momento sufriendo de cáncer de ovario. Eso, y la nueva ley, había ayudado a motivarlo: He estado en una yihad para racionalizar el proceso de revisión y sacar las cosas por la puerta más rápido, como le dijo más tarde a un entrevistador.
Pfizer presentó formalmente su solicitud al año siguiente. La compañía estaba programada para defender la droga ante un panel externo de asesores para una votación que la FDA sugirió que podría tener lugar en febrero de 2015. Rothenberg dice que asignó personal para preparar cientos de diapositivas para su posible uso durante la reunión. Luego, a finales de 2014, Pazdur llamó y le dijo que la agencia había decidido en contra del panel.
El fármaco ganó la aprobación acelerada en el mismo mes que el panel asesor se reuniría. Una de las condiciones era que Pfizer hiciera un seguimiento con los resultados de su ensayo más amplio, incluidos los datos generales de supervivencia para noviembre de 2020.
Ibrance fue un golpe casi inmediato para Pfizer. Venció a los medicamentos competidores de Novartis AG y Eli Lilly & Co. al mercado por dos años. En una conferencia de inversión en Nueva York en febrero de 2015, Lazardás Stephen Sands felicitó a su director ejecutivo, Ian Read, por haber obtenido una aprobación tan rápida con resultados preliminares. Eso fue inesperado por el mercado, creo que todo el mundo estaba sorprendido, dijo.
Albert Bourla, que entonces dirigía el negocio de oncología y vacunas de Pfizer, dijo a los inversores un mes después. Nuestros representantes fueron entrenados inmediatamente después de la aprobación y habíamos aumentado nuestra fuerza de ventas el año anterior, por lo que estaban listos.
En octubre, Pfizer informó que el crecimiento trimestral de los ingresos por oncología había alcanzado 54%, impulsado por Ibrance, los analistas en las llamadas de ganancias lloran a los ejecutivos con cumplidos “gran” durante el próximo año, ya que los médicos emitieron decenas de miles de recetas.
Pazdur, también, se ganó elogios. En los cinco años siguientes a la aprobación de la ley de avance, la FDA aprobó casi 50 nuevos medicamentos contra el cáncer, más de lo que había en la década anterior. Pazdur obtuvo un nuevo perfil público: Fortune en 2015 lo puso en la lista de revistas de los 50 mejores líderes del mundo por su trabajo en la venta de más medicamentos contra el cáncer. (El papa Francis y el líder de Apple Tim Cook estuvieron entre los otros.) En noviembre de ese año, la esposa de Pazdurs murió.

Las ventas de chubascos superaron los US$2.100 millones en 2016, y la FDA otorgó la aprobación adicional ese año para su uso en mujeres que habían fallado otros tratamientos. Después de que un ensayo más amplio confirmara los resultados iniciales que muestran retraso en el crecimiento del tumor, la FDA convirtió su aprobación acelerada a una bendición completa en 2017.
Bourla fue elevado a consejero delegado en 2019. Al año siguiente, las ventas de Ibrance alcanzaron los US$5.400 millones, lo que la convierte en uno de los tres principales productos de la compañía y representando 13% de los ingresos.
Un Pfizer entregable no fue el próximo: Los datos generales de supervivencia que originalmente había prometido presentar a la FDA en noviembre de ese año.
Sus competidores ya habían seguido adelante con estudios adicionales propios, a pesar de que entraron en el mercado más tarde. El fármaco Eli Lilly demostró en un estudio de 2019 para prolongar la supervivencia en pacientes con cáncer de mama que habían fallado otras terapias. Dos años más tarde, el producto Novartis mostró que prolongó la supervivencia un año completo cuando se usó como tratamiento inicial para el cáncer avanzado. Finalmente, en 2022, Pfizer reportó los resultados de su gran ensayo de 666 mujeres: No hubo beneficio de supervivencia para el tratamiento inicial.
Un portavoz de Pfizer dice que los resultados tardaron más de lo planeado porque los pacientes en el ensayo vivieron más de lo previsto, incluso los del grupo de control. Sus ensayos tenían como objetivo ralentizar la progresión y por lo tanto “no optimizado” para detectar una diferencia en la supervivencia, que puede ser difícil de medir debido a las terapias post-pruebas y la deserción de pacientes, agrega el portavoz. La compañía presentó un análisis en el mundo real de 9.000 pacientes en una conferencia sobre cáncer de mama a finales del año pasado que no encontró diferencia estadística en las tasas de supervivencia entre los medicamentos. (Un portavoz de Novartis dice que el estudio tenía limitaciones de diseño y sus hallazgos deberían no ser usados para comparar directamente los medicamentos.) Ibrance sigue siendo un tratamiento estándar de atención de primera línea que da a las mujeres con cáncer incurable más tiempo sin que su enfermedad empeoren y puede retrasar la necesidad de quimioterapia, dijo el portavoz de Pfizer.
Los médicos están divididos sobre qué hacer con los resultados contrastantes.
Julie Gralow, directora médica de la Sociedad Americana de Oncología Clínica, considera la falta de datos de supervivencia de Ibrance una “anomalía” que no refleja la práctica del mundo real. Gralow ha encontrado que Ibrance generalmente tiene menos efectos secundarios que sus competidores. Conseguir medicamentos prometedores a los pacientes antes, particularmente aquellos que se han quedado sin otras opciones, es importante, dice. Otros sostienen que los resultados de supervivencia reflejan diferencias sutiles pero reales que se hacen evidentes con el tiempo. Matthew Goetz, oncólogo de la Clínica Mayo en Rochester, Minnesota, dice que los beneficios de Ibrance parecen desvanecerse más rápidamente que sus competidores; favorece a los otros medicamentos.
Pazdur está convencido de que el enfoque de la FDA es correcto. Tomando prestada una línea de una canción de Black Eyed Peas, dice que los críticos que se centran en los datos de supervivencia son “so 2000” y tarde. Sugiere una serie de razones por las que las empresas comúnmente luchan para probar que sus drogas prolongan la vida. Algunos tratamientos se dirigen a tipos raros de cáncer donde hay pocos pacientes que estudiar. En otros casos, los pacientes están viviendo mucho más tiempo que confirmar las ganancias de supervivencia puede llevar años. Algunos de ellos abandonan estudios si terminan en un grupo de control por un período prolongado de tiempo.
Para los pacientes, un fármaco eficaz significa que podría ser capaz de hacer una graduación o “Puedo ser capaz de hacer una boda”, dice Pazdur. Trabajábamos para conseguir terapias seguras y eficaces a los pacientes de la manera más expedita aquí. Agrega que en cerca del 15% de los casos, los estudios de seguimiento no han logrado confirmar los beneficios de los medicamentos aprobados anticipadamente y la agencia ha impulsado su remoción. Lo interpretamos como una cifra razonable si usted está tomando el grado de riesgo apropiado, dice.
En opinión de un número creciente de especialistas en cáncer, el problema con este enfoque es que demasiados medicamentos mediocres permanecen en el mercado durante años a medida que las empresas arrastran sus pies en la producción de la evidencia que podría demostrar si realmente funcionan.
Booth, el doctor de la Universidad de Queens, ayudó a fundar un grupo llamado Oncología de sentido común en 2023 que presionaba por un retorno a estándares más altos en ensayos clínicos. Se extrajo miembros de Canadá, Estados Unidos, India, Japón, Australia, Reino Unido, Israel, Ghana, Ruanda y Brasil.
Estos médicos están de acuerdo en que los nuevos medicamentos dan esperanza a los pacientes, sólo que a veces resulta ser falsas esperanza. Mientras tanto, las compañías farmacéuticas generan miles de millones.
Takeda Pharmaceutical Co., por ejemplo, ganó la aprobación para el tratamiento de mieloma múltiple de $4,450-a píldora Ninlaro en 2015 después de que un ensayo mostrara que retrasó el crecimiento del cáncer de médula ósea en seis meses. Múltiples estudios de seguimiento no demostraron que Ninlaro extiende vidas de pacientes. También puede causar diarrea severa. Desde ese ensayo temprano, sin embargo, Takeda ha hecho más de US$4.000 millones al promocionar la píldora como la medicación primera y única en su clase que permite a los pacientes evitar un viaje a un centro de infusión.
Aaron Goodman, hematólogo de la Universidad de California en San Diego, llama a la píldora “un costoso laxante” que desvía a los pacientes de otros medicamentos mieloma que tienen ventajas probadas de supervivencia. “Cada vez que alguien está recibiendo esta droga, podría estar recibiendo algo más, dice. Un portavoz de Takeda llamó al fármaco una opción de tratamiento “importante” que ofrece a los pacientes un régimen de toda píldora, si no un beneficio de sobrevivible.
La otra preocupación por los medicamentos contra el cáncer es la cantidad. Un estudio de Mark Ratain, investigador de cáncer de la Universidad de Chicago, identificó docenas de pastillas contra el cáncer que se venden a dosis o frecuencias innecesariamente altas, lo que se suma a los efectos secundarios y de costos. La sed de beneficios e ingresos está perjudicando a los pacientes en este momento, dice Ratain.
A la mayoría de los pacientes con melanoma en estadio medio les va bien con dos dosis de tratamiento de inmunoterapia antes de la cirugía, en comparación con el régimen habitual de casi un año de fármacos como Opdivo de Bristol Myers Squibb Co. después de la cirugía, según los resultados publicados en el New England Journal of Medicine el año pasado. Los hallazgos preliminares en los Países Bajos sugirieron que la menor dosis de Merck & Co.s Keytruda también fue efectiva para mantener vivos a los pacientes de cáncer de pulmón durante un año. Y en un estudio de 1.000 pacientes publicado en Nature, investigadores del Instituto de Cáncer de Holanda mostraron que las pacientes avanzadas de cáncer de mama podrían posponer de forma segura el consumo de medicamentos como Ibrance durante más de un año sin ninguna diferencia en la progresión a largo plazo, reduciendo los efectos secundarios y ahorrando millones.
La evidencia contradictoria a menudo deja a los pacientes y sus familias cuestionando todo. Crystal Vaagen, una escritora de libros infantiles en Fargo, Dakota del Norte, dice que su madre fue diagnosticada con cáncer de mama avanzado en julio de 2021 a los 74 años. Su mamá fue puesta en Ibrance tres meses después de una cita de 20 minutos durante la cual no se mencionó ninguna otra opción de tratamiento. Los médicos no le contaron sobre el fármaco Novartis, dice Vaagen, que fue a todas las citas de su madre. Su madre permaneció en el fármaco hasta abril de 2024, cuando sus tumores comenzaron a propagarse y se cambió a quimioterapia. Murió de una infección del torrente sanguíneo, una posible complicación de la quimioterapia.
Ibrance, está bien para ella, dice Vaagen. Pero desearía que se les hubiera dicho que otras drogas tenían beneficios más probados para la vida. Si hubiera sabido que hay diferentes medicinas por ahí, habría luchado un poco más duro, dice. – Yo habría dicho, tal vez deberíamos cambiar, hay una manera de hacerlo? Pero como paciente se espera que no sepas nada.
Los costos, mientras tanto, irradian en todo el sistema de salud. Un análisis de Medicare encontró que el gasto anual en medicamentos oncológicos se duplicó con creces en los cuatro años que terminaron en 2020, a US$53.900 millones. En comparación, el Departamento de Salud y Servicios Humanos de Trump ha dicho que ahorraría a los contribuyentes $1.800 millones al año al reducir su fuerza laboral a 62.000 de 82.000.
Una de las primeras contrataciones principales del comisionado de la FDA, el médico de cáncer de UC San Francisco, Vinay Prasad, es un crítico del uso excesivo de las aprobaciones aceleradas que ha cuestionado la falta de evidencia de supervivencia para algunos medicamentos contra el cáncer. Como jefe del Centro de Evaluación e Investigación Biológicas de la FDA, supervisará la mayoría de los tratamientos contra el cáncer, que permanecen en la división de Pazdurs. Pero puede tener la oreja del comisario.
Ibrance ha traído más de US$40.000 millones para Pfizer, una década después de que el fármaco llegara al mercado con la fuerza de un ensayo de crecimiento tumoral en 165 pacientes. Las ventas se han deslizado recientemente, sin embargo. Ibrance estuvo entre 15 medicamentos seleccionados por Medicare este año para las negociaciones de precios bajo una ley de 2022 que limitó los costos de prescripción de bolsillo en US$2,000.
Bourla, el director ejecutivo de Pfizer, ha promocionado recientemente un nuevo tratamiento contra el cáncer de mama que se dirige a una proteína similar. Derivado de un compuesto Pfizer conocido como PF-07220060, este se llama atirmoiclib.
Los primeros ensayos muestran una capacidad alentadora para reducir los tumores.
Origen: Medicamentos contra el cáncer cuestan más que nunca, a menudo no extienden vidas







